Profilaxis de Úlceras por Estrés: Las Consecuencias del Uso Excesivo y el Mal Uso
US Pharm. 2011;36(10):73-76.
Parece que a casi todos los pacientes ingresados en el hospital en los Estados Unidos se les receta un inhibidor de la bomba de protones (IBP) o un antagonista de la histamina 2 (H2A) como profilaxis de la úlcera de estrés (SUP). Las úlceras por estrés son erosiones de la mucosa gástrica que pueden desarrollarse en pacientes con una enfermedad grave o lesión grave. A diferencia de las úlceras pépticas, que tienden a desarrollarse en el antro o el duodeno, las lesiones de la mucosa relacionadas con el estrés generalmente ocurren en las áreas productoras de ácido del estómago (es decir, cuerpo y fondo).1 Las úlceras por estrés, a diferencia de las úlceras pépticas, tienden a causar sangrado gastrointestinal (GI) y no se asocian con dolor abdominal. Los cambios en la mucosa de la lesión de la mucosa relacionada con el estrés involucran principalmente pequeñas erosiones que no conducen a sangrado, pero pueden convertirse en úlceras más profundas, que causan sangrado.
Varios factores contribuyen a la formación de úlceras por estrés, incluida la hipersecreción ácida; alteración de mecanismos protectores normales como secreciones de moco y bicarbonato; liberación de mediadores como metabolitos de ácido araquidónico, citoquinas y radicales libres de oxígeno; e isquemia al sistema gastrointestinal.2 Estas erosiones pueden ocurrir rápidamente (£24 horas de admisión) o tardar más en desarrollarse (>10-14 días).2 Las úlceras por estrés y las hemorragias relacionadas causan morbilidad y mortalidad significativas en pacientes críticos. Un estudio notificó una tasa de mortalidad del 46% en pacientes críticos con hemorragia gastrointestinal, en comparación con el 21% en aquellos sin hemorragia (P <.001).Otros 3 estudios han confirmado esta alta tasa de mortalidad.4,5
Estudios amplios han indicado que los factores de riesgo más fuertes para el sangrado GASTROINTESTINAL relacionado con el estrés son la ventilación mecánica prolongada y la coagulopatía.4 El riesgo aumenta con el aumento del número de días de ventilación mecánica y la duración de la estancia en la UCI.6 Otros factores de riesgo incluyen cirugía mayor reciente, trauma mayor, quemaduras graves, traumatismo craneal, enfermedad hepática o renal al ingreso, sepsis e hipotensión.1 En EL CUADRO 1 figura una lista completa de los factores de riesgo.

Terapia profiláctica
Aunque se ha demostrado que es muy eficaz para reducir el riesgo de hemorragia mucosa manifiesta y clínicamente importante relacionada con el estrés, la terapia profiláctica por sí sola no disminuye la tasa de mortalidad general.7 Sin embargo, la prescripción de IBP o H2A como SUP está respaldada por la literatura y por las directrices para la población de cuidados críticos. En los últimos años, el uso de la SUP en pacientes que no están en la UCI, a menudo sin indicación, ha aumentado. Múltiples estudios han demostrado el uso excesivo de fármacos supresores de ácido (TEA); hasta el 71% de los pacientes ingresados se les prescriben TEA, y muchos de ellos son dados de alta erróneamente con estos agentes.8 A muchos pacientes se les recetan TEA inadecuadamente en la comunidad, y se hace poco para suspender estos medicamentos durante la hospitalización. Además, los pacientes que reciben IBP dos veces al día para tratar los síntomas de la enfermedad por reflujo gastroesofágico (ERGE) a menudo no se reducen a la terapia de dosis única diaria una vez que están asintomáticos.9
El uso excesivo y el mal uso de los TEA pueden causar daños al paciente y aumentar los costos para el sistema de atención médica. El número necesario para tratar (NNT) para prevenir un solo episodio de sangrado gastrointestinal clínicamente significativo en la UCI supera los 900; el NNT se desconoce en el entorno que no pertenece a la UCI, pero se espera que sea mucho mayor.9 En un estudio de cohorte retrospectivo en un hospital académico, de los costos de hospitalización de SUP en la no-UCI fue de $44,000 anualmente y farmacia extrahospitalaria costos fueron de casi $68,000 cuando las drogas fueron continuó extrahospitalaria, para un total combinado anual estimado de gasto de casi $112,000.10 Esto podría haberse evitado fácilmente.
A la luz de estas estadísticas, la SUP sigue siendo recetada en exceso. En una encuesta transversal basada en la Web que evaluó el conocimiento, las creencias y el comportamiento de los médicos con respecto a la prescripción de SUP en pacientes que no pertenecen a la UCI, los temores sobre el sangrado GASTROINTESTINAL y las repercusiones legales de no prescribir SUP se asociaron con un mayor nivel de prescripción, mientras que el conocimiento de las indicaciones de SUP y la preocupación por los efectos secundarios se asociaron con un bajo comportamiento de prescripción.11 Menos de la mitad de los médicos pudieron identificar un solo efecto secundario de la terapia con IBP.11 Muchos profesionales ven estos medicamentos como inofensivos, pero los estudios han sugerido que la terapia con IBP y H2A está fuertemente asociada con una mayor probabilidad de infección por Clostridium difficile (CDI) y un aumento de las tasas de recurrencia.12,13 Otros riesgos que a menudo se pasan por alto asociados con esta terapia incluyen hipomagnesemia; deficiencia de vitamina B12; infecciones de las vías respiratorias superiores, incluida la neumonía adquirida en la comunidad (NAC) y la neumonía adquirida en el hospital (HAP); fracturas de cadera, columna vertebral y muñecas; y absorción alterada de medicamentos dependientes del pH.
Riesgos de la terapia
CDI: La toxina producida por C difficile, una bacteria anaeróbica, formadora de esporas y grampositiva, es una de las principales causas de diarrea y colitis en pacientes hospitalizados que ha aumentado en incidencia, gravedad y mortalidad en los últimos años. Aproximadamente 3 millones de casos ocurren anualmente en los Estados Unidos, y los costos de atención médica superan los 1 1.1 mil millones por año.La colitis pseudomembranosa inducida por difficile 14,15 C tiene una tasa de mortalidad de 6 a 30%.16 La ICD ha sido implicada en 20 a 30% de todos los casos de diarrea asociada a antibióticos, 50 a 75% de los casos de colitis asociada a antibióticos y más del 90% de los casos de colitis seudomembranosa asociada a antibióticos en pacientes hospitalizados.17
A pesar de un mejor control de la prescripción de antibióticos y mejoras en la higiene hospitalaria, el número de casos de ICD sigue aumentando.18 El diagnóstico mejorado, las cepas hipervirulentas y el envejecimiento de la población pueden haber contribuido a esto, pero estos factores no explican completamente el alcance de los aumentos recientes.18 Los factores de riesgo comunes para la ICD incluyen la edad de más de 65 años, la hospitalización actual y recurrente, la cirugía GASTROINTESTINAL reciente, la inmunosupresión, la ICD previa, la residencia en un hogar de ancianos o en un centro de atención a largo plazo y el uso de antibióticos. El uso de antibióticos es el mayor factor de riesgo para el desarrollo de CDI, pero a menudo no se puede evitar en pacientes con infecciones. Un factor de riesgo menos común pero más modificable es el uso de TEA en pacientes hospitalizados en los que estos fármacos no están indicados.
El ácido gástrico es un mecanismo protector inespecífico contra los patógenos ingeridos. El estómago normalmente está libre de bacterias, con la excepción de Helicobacter pylori, que está equipado de manera única para tratar la acidez gástrica.19 C difficile se transmite por ingestión, y sus esporas relativamente estables a los ácidos germinan en el intestino delgado y el colon. Las células vegetativas de C difficile, a diferencia de las esporas, generalmente se matan en el ambiente de bajo pH del estómago; sin embargo, se ha encontrado que permanecen viables en el contenido gástrico de pacientes que toman TEA. La investigación en modelos animales ha demostrado que las esporas de C difficile se transforman en células vegetativas dentro de 1 hora de la ingestión. Es plausible que esta transformación pueda ocurrir en el estómago si el pH es más alto o en el caso de tiempos de tránsito gástrico más lentos.
Varios estudios han encontrado una asociación entre el uso de IBP o H2A y CDI. En un estudio de cohortes retrospectivo reciente, se encontró que la ICD recidivante fue más común en pacientes expuestos a IBP que en pacientes no expuestos (25,2 vs.18,5%) y que el uso de IBP durante el tratamiento con ICD se relacionó con un aumento de 42% del riesgo de recidiva.12 pacientes expuestos mayores de 80 años tuvieron el riesgo más alto.12 Un análisis reciente de datos de altas de pacientes de un centro médico terciario durante un período de 5 años encontró que el riesgo de ICD nosocomial estaba correlacionado positivamente con el nivel de supresión ácida y era más alto en pacientes que recibían terapia con IBP más de una vez al día, lo que sugiere un efecto dosis-respuesta en el riesgo de ICD nosocomial.13
Neumonía: Aunque los resultados de las investigaciones han sido inconsistentes, varios estudios han encontrado una asociación entre el uso de TEA y un mayor riesgo de infecciones del tracto respiratorio y NAC. Una revisión sistemática y un metanálisis recientes sugirieron que el uso de IBP y H2As se asocia con un mayor riesgo de NAC y HAP, estimando la aparición de un caso de neumonía por cada 200 pacientes hospitalizados tratados con TEA.20 Considerando que entre el 40% y el 70% de los pacientes hospitalizados reciben TEA, la magnitud de la morbimortalidad de la HAP puede apreciarse plenamente. El mayor aumento del riesgo de neumonía asociado a IBP se observó en la primera semana de uso.20
Al igual que con las infecciones entéricas, se cree que los TEA aumentan el riesgo de neumonía al inhibir la secreción de ácido gástrico, lo que permite el crecimiento excesivo y la colonización bacteriana. Las bacterias pueden entonces ser translocadas a los pulmones por aspiración.20 En pacientes ventilados mecánicamente, la colonización orofaríngea con organismos gramnegativos puede conducir a la colonización gástrica.19 Otra teoría es que la trifosfatasa de adenosina de hidrógeno y potasio está presente no solo en las células parietales del estómago, sino también en el tracto respiratorio.20 La inhibición de esta enzima por un IBP podría estimular el crecimiento bacteriano en el tracto respiratorio, lo que llevaría a un mayor riesgo de neumonía.20 Por último, los estudios in vitro han demostrado que los TEA pueden perjudicar la función de los neutrófilos y la actividad de las células asesinas naturales.20
Los pacientes mayores de 65 años tienen un mayor riesgo de neumonía debido a ASD. No solo los pacientes de edad avanzada generalmente son hipoclorados debido al proceso de envejecimiento, sino que el uso de IBP o H2A es común en este grupo; hasta el 5% toma estos medicamentos regularmente, y un alto porcentaje de pacientes de edad avanzada hospitalizados reciben SUP.21 Además, muchos IBP y H2A no requieren receta médica, lo que resulta en un mayor uso sin supervisión, a menudo durante largos períodos de tiempo sin supervisión médica.21
Otros riesgos: Además de la ICD, se han asociado con ASD otras infecciones entéricas, en particular de especies de Salmonella y Campylobacter. Tanto Campylobacter como Salmonella son microbios sensibles a los ácidos. Las infecciones parasitarias también se han relacionado con la supresión de ácidos, especialmente la giardiasis y la estrongiloidiasis.22 Como se mencionó anteriormente, el ácido gástrico es importante para matar a los organismos ingeridos, pero un pH gástrico elevado puede tener otros efectos negativos en las defensas del huésped GI, como retraso en el vaciado gástrico, aumento de la translocación bacteriana, disminución de la viscosidad del moco gástrico y cambios en la flora microbiana normal.23
Las interacciones medicamentosas son otra preocupación con la supresión ácida. Los medicamentos con absorción dependiente del pH (es decir, digoxina, nifedipina, indinavir, midazolam, didanosina, alendronato, metadona, aspirina) pueden verse afectados tanto por los IBP como por los H2As, lo que resulta en un aumento de las tasas de absorción.9,24 Del mismo modo, varios fármacos tienen tasas de absorción reducidas (es decir, ketoconazol, cefpodoxima, dipiridamol, atazanavir, itraconazol).24 Existen muchas interacciones relacionadas con el CYP450 entre los IBP y otros fármacos. La interacción potencial entre IBP y clopidogrel ha atraído la atención debido a posibles efectos adversos graves. Una alerta de seguridad de la FDA en noviembre de 2009 recomendó evitar el uso de omeprazol o esomeprazol con clopidogrel, advirtiendo que la interacción mediada por CYP podría reducir la eficacia de clopidogrel.22 Debido a la insuficiencia de datos, la FDA no hizo recomendaciones específicas con respecto a otros IBP.22
Se han reportado varios casos de pacientes con hipomagnesemia y posterior hipocalcemia e hipocalcemia que presentaron síntomas potencialmente mortales que requirieron hospitalización. La mayoría de estos casos se asociaron con el uso de IBP a largo plazo. Se desconoce el mecanismo de este efecto adverso. En pacientes con hipomagnesemia inducida por IBP, no se ha producido una malabsorción aparente de magnesio ni una emaciación renal de magnesio.22 Aunque la hipomagnesemia es poco frecuente, se recomienda a los proveedores que ponen en peligro la vida que vigilen cuidadosamente la hipomagnesemia, la hipocalcemia o la hipocalcemia inexplicables en los usuarios de IBP.22
El uso de IBP durante 12 meses o más se ha asociado con deficiencia de vitamina B12, particularmente en pacientes de edad avanzada.9 La acidez gástrica y la pepsina permiten la liberación de vitamina B12 ingerida desde su estado unido a proteínas; por lo tanto, la reducción del ácido gástrico puede llevar a una mala absorción y a una deficiencia de vitamina B12.22 Los resultados de los estudios han sido inconsistentes, y se necesitan estudios más amplios para definir la asociación entre el uso de IBP y la malabsorción de vitamina B12 y la deficiencia posterior. La mala absorción del hierro dietético también se ha relacionado con la terapia con IBP, pero los datos actuales son débiles. El ácido gástrico facilita la absorción de hierro no hemo al reducir el hierro férrico a la forma ferrosa más soluble, y también mejora la disociación de hierro y sal de los alimentos ingeridos.22 Existen varios informes de casos, pero no se han realizado estudios prospectivos en esta área.
El uso a largo plazo de IBP se ha asociado con un aumento de la incidencia de fracturas. Los posibles mecanismos incluyen una disminución de la absorción de calcio en un entorno gástrico más alcalino y un deterioro de la remodelación ósea debido a la disminución de la actividad osteoclástica, lo que conduce a la reparación inhibida de la microfractura.22 Una vez más, los estudios son inconsistentes, pero la evidencia existente fue suficiente para que la FDA revisara la etiqueta de los IBP en mayo de 2010 para incluir nueva información de seguridad sobre el posible aumento del riesgo de fracturas de cadera, muñeca y columna vertebral.22 El riesgo de fractura puede ser más significativo clínicamente en pacientes con osteoporosis u otros factores de riesgo de fractura, como el uso de esteroides. Se alienta a los médicos a sopesar los riesgos y beneficios del uso de IBP en pacientes vulnerables. Si se recetan suplementos de calcio a los usuarios de IBP, deben estar en una forma soluble, como citrato, en lugar de carbonato.22
Uso apropiado
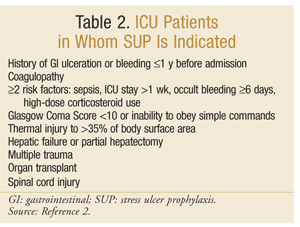
La Sociedad Americana de Farmacéuticos del Sistema de Salud ha desarrollado una de las directrices más completas basadas en la evidencia para la SUP. Las directrices terapéuticas actuales se publicaron en 1999, con una actualización en curso en este momento.25 La SUP no se recomienda para pacientes que no pertenecen a la UCI; la profilaxis se recomienda solo para pacientes de UCI que requieren ventilación mecánica durante más de 48 horas, tienen antecedentes de ulceración gastrointestinal o sangrado dentro de 1 año antes del ingreso, o que tienen coagulopatía. También se recomienda profilaxis para pacientes en la UCI con al menos dos de los siguientes factores de riesgo: sepsis, permanencia en la UCI superior a 1 semana, sangrado oculto que dure 6 días o más y el uso de corticosteroides en dosis altas (hidrocortisona >250 mg/día o equivalente). Además, la SUP se recomienda para poblaciones especiales de UCI, como pacientes con un puntaje de Coma de Glasgow < 10 (o incapacidad para obedecer órdenes simples), lesión térmica a >35% del área de superficie corporal, insuficiencia hepática o hepatectomía parcial, trauma múltiple, trasplantes o lesión de la médula espinal.2 Las recomendaciones se resumen en el CUADRO 2.
Conclusión: El papel del farmacéutico
Los esfuerzos de los médicos para frenar el uso de TEA en pacientes que no pertenecen a la UCI pueden prevenir una morbilidad significativa de los pacientes y reducir los costos hospitalarios y los costos para el sistema de atención de salud en general. Es importante sopesar cuidadosamente los riesgos y beneficios de los Tea antes de usar estos medicamentos en el hospital. Se debe prestar especial atención a los pacientes que ya están en riesgo de neumonía, como los ancianos, los que tienen enfermedad pulmonar crónica y los que toman inmunosupresores. Se debe hacer todo lo posible para evaluar críticamente la terapia de supresión ácida en pacientes hospitalizados y suspender la terapia siempre que sea posible. Cuando esté indicada la SUP, el paciente debe recibir la dosis más baja posible.
Los farmacéuticos pueden ayudar a detener el uso de TEA al identificar a los pacientes a los que se les recetan estos medicamentos de manera inapropiada, y pueden ser fundamentales para educar a los médicos sobre qué pacientes deben recibir SUP. Los farmacéuticos involucrados en el procesamiento de los medicamentos de alta pueden ayudar a garantizar que los pacientes no sean enviados a casa con terapia supresora de ácido sin una indicación adecuada. Desafortunadamente, las medidas tomadas para prevenir las úlceras por estrés en pacientes hospitalizados han creado un nuevo problema, y al trabajar juntos, el equipo de atención médica puede ayudar a prevenir una mayor morbilidad innecesaria al hacer cumplir las recomendaciones de las pautas en su institución.
1. Spirt MJ. Enfermedad de la mucosa relacionada con el estrés: factores de riesgo y terapia profiláctica. Clin Ther. 2004;26:197-213.
2. Directrices terapéuticas de la ASHP para la profilaxis de las úlceras por estrés. Comisión de Terapias de la ASHP y aprobada por la Junta Directiva de la ASHP el 14 de noviembre de 1998. Am J Health Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, Walter SD, et al. La mortalidad atribuible y la duración de la estancia en la unidad de cuidados intensivos de hemorragias gastrointestinales clínicamente importantes en pacientes en estado crítico. Cuidado de Hematocrito. 2001;5:368-375.
4. Cook DJ, Fuller HD, Guyatt GH, et al. Factores de riesgo de sangrado gastrointestinal en pacientes en estado crítico. Canadian Critical Care Trials Group (en inglés). N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. Objetivos terapéuticos y opciones de tratamiento para la prevención del síndrome de úlcera por estrés. Am J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth WE. Hemorragia gastrointestinal en pacientes en una unidad de cuidados intensivos respiratorios. Pecho. 1977;72:301-304.
7. Sesler JM. Enfermedad de la mucosa relacionada con el estrés en la unidad de cuidados intensivos: una actualización de la profilaxis. Cuidado de Hematocrito Adv AACN. 2007;18:119-128.
8. Grube RR, May DB. Profilaxis de úlceras por estrés en pacientes hospitalizados que no están en unidades de cuidados intensivos. Am J Health Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Sobreutilización de inhibidores de la bomba de protones: una revisión de la rentabilidad y el riesgo en IBP. Am J Gastroenterol. 2009; 104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Magnitud e impacto económico del uso inadecuado de profilaxis de úlceras por estrés en pacientes hospitalizados no en UCI. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. ¿Por qué los médicos prescriben profilaxis de úlceras de estrés a pacientes de medicina general? South Med J. 2010;103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Inhibidores de la bomba de protones y riesgo de infección recurrente por Clostridium difficile. Arch Intern Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Supresión de ácido gástrico iatrogénico y riesgo de infección nosocomial por Clostridium difficile. Arch Intern Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Costos de atención médica y mortalidad asociados con diarrea nosocomial debido a Clostridum difficile. Clin Infect Dis. 2002;34:346-353.
15. Diarrea asociada a Clostridium difficile. Médico de Familia. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: hallazgos epidemiológicos recientes y avances en terapia. Farmacoterapia. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Colitis por Clostridium difficile. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. ¿El uso excesivo de inhibidores de la bomba de protones está alimentando la epidemia actual de diarrea asociada a Clostridium difficile? J Hosp Infect. 2008;70:1-6.
19. Vakil N. Inhibición ácida e infecciones fuera del tracto gastrointestinal. Am J Gastroenterol. 2009; 104: S17-S20.
20. Eom CS, Jeon CY, Lim JW, et al. Uso de fármacos supresores de ácido y riesgo de neumonía: una revisión sistemática y meta-análisis. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Neumonía adquirida en la comunidad recurrente en pacientes que inician medicamentos supresores de ácido. Am J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. Efectos adversos en el tratamiento a largo plazo con inhibidores de la bomba de protones. Dig Dis Sci. 2011;56:931-950.
23. Marque el uso de inhibidores de la bomba de protones de la Sra. e infecciones entéricas. Am J Gastroenterol. 2009; 104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Revisión sistemática: absorción alterada de fármacos relacionada con la administración conjunta de terapia antisecretora. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. Sociedad Americana de Farmacéuticos del Sistema de Salud. Terapéutica guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. Consultado el 19 de septiembre de 2011.