Profilassi dell’ulcera da stress: le conseguenze dell’uso eccessivo e dell’abuso
NOI Pharm. 2011;36(10):73-76.
Sembra che quasi ogni paziente ricoverato in ospedale negli Stati Uniti sia prescritto un inibitore della pompa protonica (PPI) o un antagonista dell’istamina-2 (H2A) come profilassi dell’ulcera da stress (SUP). Le ulcere da stress sono erosioni della mucosa gastrica che possono svilupparsi in pazienti con una malattia grave o lesioni gravi. A differenza delle ulcere peptiche, che tendono a svilupparsi nell’antro o nel duodeno, le lesioni della mucosa correlate allo stress si verificano in genere nelle aree di produzione acida dello stomaco (cioè corpus e fondo).1 Le ulcere da stress, a differenza delle ulcere peptiche, tendono a causare sanguinamento gastrointestinale (GI) e non sono associate a dolore addominale. I cambiamenti della mucosa della lesione della mucosa correlata allo stress coinvolgono principalmente piccole erosioni che non portano a sanguinamento ma possono svilupparsi in ulcere più profonde, che causano sanguinamento.
Diversi fattori contribuiscono alla formazione di ulcere da stress, inclusa l’ipersecrezione acida; alterazione dei meccanismi protettivi normali quali le secrezioni del bicarbonato e del muco; rilascio dei mediatori quali i metaboliti dell’acido arachidonico, le citochine ed i radicali liberi dell’ossigeno; e ischemia al sistema di GI.2 Queste erosioni possono verificarsi rapidamente (£24 ore di ammissione) o richiedere più tempo per svilupparsi (>10-14 giorni).2 Le ulcere da stress e il sanguinamento correlato causano una significativa morbilità e mortalità nei pazienti critici. Uno studio ha riportato un tasso di mortalità del 46% nei pazienti critici con sanguinamento gastrointestinale rispetto al 21% in quelli senza sanguinamento (P <.001).3 Altri studi hanno confermato questo alto tasso di mortalità.4,5
Ampi studi hanno indicato che i più forti fattori di rischio per il sanguinamento gastrointestinale correlato allo stress sono la ventilazione meccanica prolungata e la coagulopatia.4 Il rischio aumenta con l’aumentare del numero di giorni di ventilazione meccanica e la durata del soggiorno in terapia intensiva.6 Altri fattori di rischio includono recente chirurgia maggiore, trauma maggiore, gravi ustioni, trauma cranico, malattia epatica o renale al momento del ricovero, sepsi e ipotensione.1 La TABELLA 1 fornisce un elenco completo dei fattori di rischio.

La terapia profilattica
Sebbene abbia dimostrato di essere altamente efficace nel ridurre il rischio di sanguinamento mucoso sia palese che clinicamente importante correlato allo stress, la terapia profilattica da sola non diminuisce il tasso di mortalità generale.7 Tuttavia, la prescrizione di PPI o H2AS come SUP è supportata dalla letteratura e dalle linee guida per la popolazione di cure critiche. Negli ultimi anni, l’uso di SUP in pazienti non in terapia intensiva-spesso senza alcuna indicazione—è aumentato. Diversi studi hanno dimostrato l’uso eccessivo di farmaci acido-soppressivi (ASD); ben il 71% dei pazienti ricoverati sono prescritti ASDs, con molti che vengono erroneamente scaricati con questi agenti.8 Molti pazienti sono prescritti in modo inappropriato ASDs nella comunità, e poco è fatto per interrompere questi farmaci durante il ricovero in ospedale. Inoltre, i pazienti trattati con PPI due volte al giorno per trattare i sintomi della malattia da reflusso gastroesofageo (GERD) spesso non vengono ridotti alla terapia a dose singola giornaliera una volta che sono asintomatici.9
L’uso eccessivo e l’uso improprio di ASDs possono causare danni ai pazienti e un aumento dei costi per il sistema sanitario. Il numero necessario per il trattamento (NNT) per prevenire un singolo episodio di sanguinamento GI clinicamente significativo nella terapia intensiva supera 900; l’NNT è sconosciuto nell’impostazione non ICU, ma dovrebbe essere molto più alto.9 In uno studio di coorte retrospettivo in un ospedale accademico, i costi ospedalieri per SUP nell’impostazione non ICU erano annually 44,000 all’anno e i costi della farmacia ambulatoriale erano quasi $68,000 quando i farmaci venivano continuati postdiscarica, per una spesa annuale stimata combinata di quasi $112,000.10 Questo potrebbe essere stato facilmente evitato.
Alla luce di queste statistiche, la SUP continua ad essere sovraprescritta. In un sondaggio trasversale basato sul Web che valuta le conoscenze, le credenze e il comportamento dei medici in merito alla prescrizione di SUP in pazienti non in terapia intensiva, i timori sul sanguinamento gastrointestinale e le ripercussioni legali della mancata prescrizione di SUP sono stati associati a un livello di prescrizione più elevato, mentre la conoscenza delle indicazioni SUP e la preoccupazione11 Meno della metà dei medici ha potuto identificare un singolo effetto collaterale della terapia PPI.11 Molti praticanti considerano questi farmaci innocui, ma gli studi hanno suggerito che la terapia PPI e H2A è fortemente associata a una maggiore probabilità di infezione da clostridium difficile (CDI) e aumento dei tassi di recidiva.12,13 Altri rischi spesso trascurati associati a questa terapia includono ipomagnesemia; carenza di vitamina B12; infezioni respiratorie superiori, tra cui polmonite acquisita in comunità (CAP) e polmonite acquisita in ospedale (HAP); fratture dell’anca, della colonna vertebrale e dei polsi; e assorbimento alterato di farmaci dipendenti dal pH.
Rischi della terapia
CDI: La tossina prodotta da C difficile, un batterio anaerobico, spore-formante, gram-positivo, è una delle principali cause di diarrea e colite nei pazienti ospedalizzati che è aumentata in incidenza, gravità e mortalità negli ultimi anni. Circa 3 milioni di casi si verificano ogni anno negli Stati Uniti e i costi sanitari superano $1,1 miliardi all’anno.La colite pseudomembranosa indotta da 14,15 C difficile ha un tasso di mortalità dal 6% al 30%.16 CDI è stato implicato nel 20% al 30% di tutti i casi di diarrea associata agli antibiotici, dal 50% al 75% dei casi di colite associata agli antibiotici e oltre il 90% dei casi di colite pseudomembranosa associata agli antibiotici nei pazienti ospedalizzati.17
Nonostante un migliore controllo della prescrizione di antibiotici e miglioramenti nell’igiene ospedaliera, il numero di casi di CDI continua ad aumentare.18 Il miglioramento della diagnosi, i ceppi ipervirulenti e l’invecchiamento della popolazione possono aver contribuito a questo, ma questi fattori non spiegano completamente l’entità dei recenti aumenti.18 Fattori di rischio comuni per la CDI includono età superiore a 65 anni, ospedalizzazione attuale e ricorrente, recente chirurgia GI, immunosoppressione, CDI precedente, residente in una casa di cura o in una struttura di assistenza a lungo termine e uso di antibiotici. L’uso di antibiotici è il più grande fattore di rischio per lo sviluppo di CDI, ma spesso non può essere evitato nei pazienti con infezioni. Un fattore di rischio meno comune ma più modificabile è l’uso di ASD in pazienti ospedalizzati in cui questi farmaci non sono indicati.
L’acido gastrico è un meccanismo protettivo non specifico contro i patogeni ingeriti. Lo stomaco è normalmente privo di batteri, ad eccezione di Helicobacter pylori, che è dotato unicamente per affrontare l’acidità gastrica.19 C difficile viene trasmesso per ingestione e le sue spore relativamente stabili all’acido continuano a germinare nell’intestino tenue e nel colon. Le cellule vegetative di C difficile, a differenza delle spore, sono solitamente uccise nell’ambiente a basso pH dello stomaco; tuttavia, sono state trovate per rimanere vitali nel contenuto gastrico dei pazienti che assumono ASDs. La ricerca in modelli animali ha dimostrato che le spore di C difficile si trasformano in cellule vegetative entro 1 ora dall’ingestione. È plausibile che questa trasformazione possa verificarsi nello stomaco se il pH è più alto o nel caso di tempi di transito gastrici più lenti.
Diversi studi hanno trovato un’associazione tra l’uso di PPI o H2A e CDI. Un recente studio di coorte retrospettivo ha rilevato che la CDI ricorrente era più comune nei pazienti esposti a PPI rispetto ai pazienti non esposti (25,2% contro 18,5%) e che l’uso di PPI durante il trattamento con CDI era associato ad un aumento del 42% del rischio di recidiva.12 Pazienti esposti di età superiore agli 80 anni avevano il rischio più alto.12 Una recente analisi dei dati delle scariche di pazienti da un centro medico terziario per un periodo di 5 anni ha rilevato che il rischio di CDI nosocomiale era positivamente correlato con il livello di soppressione acida ed era più alto nei pazienti che ricevevano terapia PPI più di una volta al giorno, suggerendo un effetto dose-risposta sul rischio di CDI nosocomiale.13
Polmonite: Sebbene i risultati delle indagini siano stati incoerenti, diversi studi hanno trovato un’associazione tra l’uso di ASDs e un aumentato rischio di infezioni del tratto respiratorio e CAP. Una recente revisione sistematica e meta-analisi hanno suggerito che l’uso di PPI e H2AS è associato a un maggiore rischio di CAP e HAP, stimando un evento di un caso di polmonite per ogni 200 pazienti ricoverati trattati con ASD.20 Considerando che dal 40% al 70% dei pazienti ricoverati ricevono ASD, l’entità della morbilità e della mortalità dell’HAP può essere pienamente apprezzata. Il più grande aumento del rischio di polmonite associato a PPI è stato osservato nella prima settimana di utilizzo.20
Come per le infezioni enteriche, si pensa che le ASD aumentino il rischio di polmonite inibendo la secrezione di acido gastrico, consentendo così la crescita eccessiva e la colonizzazione batterica. I batteri possono quindi essere traslocati nei polmoni mediante aspirazione.20 Nei pazienti ventilati meccanicamente, la colonizzazione orofaringea con organismi gram-negativi può portare alla colonizzazione gastrica.19 Un’altra teoria è che l’idrogeno potassio adenosina trifosfatasi è presente non solo nelle cellule parietali dello stomaco, ma anche nel tratto respiratorio.20 L’inibizione di questo enzima da parte di un PPI potrebbe incoraggiare la crescita batterica nel tratto respiratorio, portando così ad un aumento del rischio di polmonite.20 Infine, studi in vitro hanno dimostrato che le ASD possono compromettere la funzione dei neutrofili e l’attività delle cellule natural killer.20
I pazienti di età superiore a 65 anni sono ad aumentato rischio di polmonite a causa di ASDs. Non solo i pazienti anziani sono generalmente ipoclorici a causa del processo di invecchiamento, ma l’uso di PPI o H2A è comune in questo gruppo; fino al 5% prende regolarmente questi farmaci e un’alta percentuale di pazienti anziani ospedalizzati riceve SUP.21 Inoltre, molti PPI e H2A non richiedono una prescrizione, con conseguente aumento e unmonitored uso, spesso per lunghi periodi di tempo senza controllo medico.21
Altri rischi: Oltre alla CDI, altre infezioni enteriche—in particolare, da Salmonella e Campylobacter specie—sono state associate con ASDs. Sia il Campylobacter che la salmonella sono microbi sensibili agli acidi. Le infezioni parassitarie sono state collegate alla soppressione acida pure, particolarmente giardiasi e strongyloidiasis.22 Come accennato in precedenza, l’acido gastrico è importante nell’uccisione degli organismi ingeriti, ma un pH gastrico elevato può avere altri effetti negativi sulle difese dell’ospite GI, come lo svuotamento gastrico ritardato, aumento della traslocazione batterica, diminuzione della viscosità del muco gastrico e cambiamenti nella normale flora microbica.23
Le interazioni farmacologiche sono un’altra preoccupazione per la soppressione dell’acido. I farmaci con assorbimento pH-dipendente (cioè digossina, nifedipina, indinavir, midazolam, didanosina, alendronato, metadone, aspirina) possono essere influenzati sia da PPI che da H2AS, con conseguente aumento dei tassi di assorbimento.9,24 Allo stesso modo, diversi farmaci hanno ridotto i tassi di assorbimento (cioè, ketoconazolo, cefpodoxima, dipiridamolo, atazanavir, itraconazolo).24 Ci sono molte interazioni correlate al CYP450 tra i PI e altri farmaci. La potenziale interazione tra gli IPP e clopidogrel ha attirato l’attenzione a causa di possibili effetti avversi gravi. Un avviso di sicurezza della FDA nel novembre 2009 ha raccomandato di evitare l’uso di omeprazolo o esomeprazolo con clopidogrel, avvertendo che l’interazione mediata dal CYP potrebbe ridurre l’efficacia di clopidogrel.22 A causa di dati insufficienti, la FDA non ha formulato raccomandazioni specifiche riguardanti altri PPI.22
Sono stati riportati diversi casi di pazienti con ipomagnesiemia e successiva ipopotassiemia e ipocalcemia che presentavano sintomi potenzialmente letali che richiedevano il ricovero in ospedale. La maggior parte di questi casi è stata associata all’uso a lungo termine di PPI. Il meccanismo di questo effetto avverso è sconosciuto. Nei pazienti con ipomagnesemia indotta da PPI, non si è verificato alcun apparente malassorbimento di magnesio o spreco di magnesio renale.22 Sebbene l’ipomagnesemia sia rara, perché è così pericolosa per la vita i fornitori sono incoraggiati a guardare attentamente per ipomagnesemia inspiegabile, ipopotassiemia o ipocalcemia negli utenti PPI.22
L’uso di PPI per 12 mesi o più è stato associato a carenza di vitamina B12, in particolare nei pazienti anziani.9 Acidità gastrica e pepsina consentono il rilascio di vitamina B12 ingerita dal suo stato legato alle proteine; pertanto, la riduzione dell’acido gastrico può portare a malassorbimento e carenza di vitamina B12.I risultati dello studio 22 sono stati incoerenti e sono necessari studi più ampi per definire l’associazione tra l’uso di PPI e il malassorbimento della vitamina B12 e la conseguente carenza. Anche lo scarso assorbimento del ferro alimentare è stato collegato alla terapia PPI, ma i dati attuali sono deboli. L’acido gastrico facilita l’assorbimento del ferro non ematico riducendo il ferro ferrico alla forma ferrosa più solubile e migliora anche la dissociazione del sale di ferro dal cibo ingerito.22 Esistono diverse relazioni di casi, ma non sono stati condotti studi prospettici in questo settore.
L ‘uso a lungo termine di PPI è stato associato ad un aumento dell’ incidenza di fratture. I meccanismi possibili comprendono l’assorbimento diminuito di calcio in un ambiente gastrico più alcalino e la compromissione del rimodellamento osseo dovuto l’attività diminuita dell’osteoclasto, piombo alla riparazione inibita della microfrattura.22 Ancora una volta, gli studi sono incoerenti, ma le prove esistenti sono state sufficienti per indurre la FDA a rivedere l’etichettatura PPI nel maggio 2010 per includere nuove informazioni sulla sicurezza sul possibile aumento del rischio di fratture dell’anca, del polso e della colonna vertebrale.22 Il rischio di frattura può essere più clinicamente significativo nei pazienti con osteoporosi o altri fattori di rischio per la frattura, come l’uso di steroidi. I medici sono incoraggiati a valutare i rischi e i benefici dell’uso di PPI in pazienti vulnerabili. Se gli integratori di calcio sono prescritti agli utenti di PPI, dovrebbero essere in una forma solubile, come il citrato, piuttosto che il carbonato.22
Uso appropriato
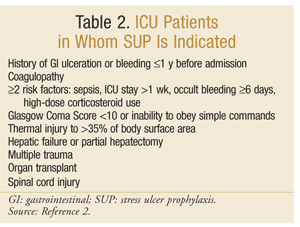
L’American Society of Health-System Pharmacists ha sviluppato una delle linee guida più complete basate sull’evidenza per SUP. Le attuali linee guida terapeutiche sono state pubblicate nel 1999, con un aggiornamento in corso in questa scrittura.25 Il SUP non è raccomandato per i pazienti non in terapia intensiva; la profilassi è raccomandata solo per i pazienti in terapia intensiva che richiedono ventilazione meccanica per più di 48 ore, hanno una storia di ulcerazione GI o sanguinamento entro 1 anno prima del ricovero o che hanno coagulopatia. Si consiglia la profilassi anche per i pazienti in terapia intensiva con almeno due dei seguenti fattori di rischio: sepsi, permanenza in terapia intensiva superiore a 1 settimana, sanguinamento occulto della durata di 6 giorni o più e uso di corticosteroidi ad alte dosi (idrocortisone >250 mg/die o equivalente). Inoltre, SUP è raccomandato per popolazioni speciali di terapia intensiva, come pazienti con un punteggio di coma di Glasgow <10 (o incapacità di obbedire a semplici comandi), lesioni termiche a >35% della superficie corporea, insufficienza epatica o epatectomia parziale, traumi multipli, trapianti o lesioni del midollo spinale.2 Le raccomandazioni sono riassunte nella TABELLA 2.
Conclusione: Il ruolo del farmacista
Gli sforzi dei medici per frenare l’uso di ASD nei pazienti non ICU possono prevenire una significativa morbilità del paziente e ridurre sia i costi ospedalieri che i costi per il sistema sanitario generale. È importante valutare attentamente i rischi e i benefici dell’ASD prima di utilizzare questi farmaci nell’ambiente ospedaliero. Si deve prestare particolare attenzione ai pazienti già a rischio di polmonite, come gli anziani, quelli con malattia polmonare cronica e quelli che assumono immunosoppressori. Ogni sforzo deve essere fatto per valutare criticamente la terapia di soppressione dell’acido nei pazienti ricoverati e per interrompere la terapia quando possibile. Quando è indicato SUP, il paziente deve ricevere la dose più bassa possibile.
I farmacisti possono aiutare ad arginare l’uso di ASD identificando i pazienti a cui sono stati prescritti in modo inappropriato questi farmaci e possono essere strumentali nell’educare i medici su quali pazienti dovrebbero ricevere SUP. I farmacisti coinvolti nell’elaborazione dei farmaci di scarico possono aiutare a garantire che i pazienti non vengano mandati a casa in terapia acido-soppressiva senza un’indicazione appropriata. Sfortunatamente, le misure adottate per prevenire le ulcere da stress nei pazienti ospedalizzati hanno creato un nuovo problema e, lavorando insieme, il team sanitario può aiutare a prevenire ulteriori morbosità inutili applicando le raccomandazioni delle linee guida al loro istituto.
1. Spirt MJ. Malattia della mucosa correlata allo stress: fattori di rischio e terapia profilattica. Clin. 2004;26:197-213.
2. Linee guida terapeutiche ASHP sulla profilassi dell’ulcera da stress. ASHP Commission on Therapeutics e approvato dal Consiglio di amministrazione dell’ASHP il 14 novembre 1998. Am J Salute Syst Pharm. 1999;56:347-379.
3. I nostri servizi sono a vostra disposizione. La mortalità attribuibile e la durata del soggiorno in unità di terapia intensiva di sanguinamento gastrointestinale clinicamente importante in pazienti critici. Cura critica. 2001;5:368-375.
4. Per maggiori informazioni:
5. Zuckerman GR, Shuman R. Obiettivi terapeutici e opzioni di trattamento per la prevenzione della sindrome da ulcera da stress. Sono J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth WE. Emorragia gastrointestinale in pazienti in un’unità di terapia intensiva respiratoria. Petto. 1977;72:301-304.
7. Sesler JM. Malattia della mucosa correlata allo stress nell’unità di terapia intensiva: un aggiornamento sulla profilassi. AACN Adv Crit Cura. 2007;18:119-128.
8. Grube RR, può DB. Profilassi dell’ulcera da stress in pazienti ospedalizzati non in unità di terapia intensiva. Am J Salute Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Overutilization degli inibitori della pompa protonica: una revisione di costo-efficacia e rischio in PPI. Am J Gastroenterol. 2009;104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Grandezza e impatto economico dell’uso inappropriato della profilassi dell’ulcera da stress nei pazienti ospedalizzati non in terapia intensiva. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. Perché i medici prescrivono la profilassi dell’ulcera da stress ai pazienti di medicina generale? Sud Med J. 2010;103:1103-1110.
12. Il sito utilizza cookie tecnici e di terze parti. Inibitori della pompa protonica e rischio di infezione ricorrente da Clostridium difficile. Arch Stagista Med. 2010;170:772-778.
13. Il sito utilizza cookie tecnici e di terze parti. Soppressione acida gastrica iatrogena e rischio di infezione da clostridium difficile nosocomiale. Arch Stagista Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Costi sanitari e mortalità associati a diarrea nosocomiale dovuta a Clostridum difficile. Clin Infettare Dis. 2002;34:346-353.
15. Schroeder Diarrea associata a Clostridium difficile. Am Fam Medico. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: recenti scoperte epidemiologiche e progressi nella terapia. Farmacoterapia. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Colite da clostridium difficile. N Ingl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. L’uso eccessivo di inibitori della pompa protonica alimenta l’attuale epidemia di diarrea associata a clostridium difficile? J Hosp Infettare. 2008;70:1-6.
19. Vakil N. Inibizione acida e infezioni al di fuori del tratto gastrointestinale. Am J Gastroenterol. 2009;104: S17-S20.
20. Eom CS, Jeon CY, Lim JW, et al. Uso di farmaci acido-soppressivi e rischio di polmonite: una revisione sistematica e meta-analisi. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Polmonite acquisita in comunità ricorrente in pazienti che iniziano farmaci che sopprimono l’acido. Sono J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. Effetti avversi sulla terapia inibitrice della pompa protonica a lungo termine. Dig Dis Sci. 2011;56:931-950.
23. Comporre MS. Uso inibitore della pompa protonica e infezioni enteriche. Am J Gastroenterol. 2009;104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Revisione sistematica: assorbimento alterato del farmaco correlato alla co-somministrazione di terapia antisecretoria. Alimento Pharmacol Ther. 2009;29:1219-1229.
25. Società americana dei farmacisti del sistema sanitario. Terapeutico guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. Accesso 19 settembre 2011.