Profilaxia ulcerului de stres: consecințele utilizării excesive și a utilizării necorespunzătoare
us Pharm. 2011;36(10):73-76.
se pare că aproape fiecare pacient internat în spitalul din Statele Unite este prescris fie un inhibitor al pompei de protoni (PPI), fie un antagonist al histaminei-2 (H2A) ca profilaxie a ulcerului de stres (SUP). Ulcerele de stres sunt eroziuni ale mucoasei gastrice care se pot dezvolta la pacienții cu o boală gravă sau leziuni grave. Spre deosebire de ulcerele peptice, care tind să se dezvolte în antrum sau duoden, leziunile mucoasei legate de stres apar de obicei în zonele producătoare de acid ale stomacului (adică corpus și fundus).1 ulcerele de stres, spre deosebire de ulcerele peptice, tind să provoace sângerări gastrointestinale (GI) și nu sunt asociate cu dureri abdominale. Modificările mucoasei leziunilor mucoasei legate de stres implică în principal eroziuni mici care nu duc la sângerare, dar se pot dezvolta în ulcere mai profunde, care provoacă sângerare.
mai mulți factori contribuie la formarea ulcerului de stres, inclusiv hipersecreția acidă; modificarea mecanismelor normale de protecție, cum ar fi secrețiile de mucus și bicarbonat; eliberarea mediatorilor, cum ar fi metaboliții acidului arahidonic, citokinele și radicalii liberi de oxigen; și ischemia în sistemul GI.2 aceste eroziuni pot apărea rapid (24 de ore de la internare) sau pot dura mai mult timp pentru a se dezvolta (>10-14 zile).2 ulcerele de stres și sângerările asociate provoacă morbiditate și mortalitate semnificative la pacienții cu afecțiuni critice. Un studiu a raportat o rată a mortalității de 46% la pacienții cu boli critice cu sângerare GI, comparativ cu 21% la cei fără sângerare (P <.001).Alte 3 studii au confirmat această rată ridicată a mortalității.4,5
studii ample au indicat că cei mai puternici factori de risc pentru sângerarea GI legată de stres sunt ventilația mecanică prelungită și coagulopatia.4 riscul crește odată cu creșterea numărului de zile de ventilație mecanică și durata șederii UCI.6 alți factori de risc includ intervenții chirurgicale majore recente, traume majore, arsuri severe, traumatisme craniene, boli hepatice sau renale la admitere, sepsis și hipotensiune.1 Tabelul 1 oferă o listă completă a factorilor de risc.

terapia profilactică
deși s-a dovedit a fi foarte eficientă în reducerea riscului de sângerare mucoasă atât evidentă, cât și importantă din punct de vedere clinic, legată de stres, terapia profilactică singură nu scade rata globală a mortalității.7 totuși, prescrierea IPP sau H2As ca SUP este susținută de literatura de specialitate și de liniile directoare pentru populația de îngrijire critică. În ultimii ani, utilizarea SUP la pacienții non-UTI—adesea fără indicații—a crescut. Mai multe studii au demonstrat utilizarea excesivă a medicamentelor supresoare de acid (ASDs); până la 71% dintre pacienții admiși sunt prescrise TSA, mulți fiind externați în mod eronat cu acești agenți.8 mulți pacienți sunt prescrise necorespunzător TSA în comunitate și se face puțin pentru a întrerupe aceste medicamente în timpul spitalizării. În plus, pacienții cărora li se administrează IPP de două ori pe zi pentru a trata simptomele bolii de reflux gastroesofagian (GERD) adesea nu sunt reduse la terapia cu doză unică zilnică odată ce sunt asimptomatici.9
utilizarea excesivă și abuzivă a TSA poate duce la vătămarea pacientului și la creșterea costurilor pentru sistemul de sănătate. Numărul necesar pentru tratament (NNT) pentru a preveni un singur episod de sângerare GI semnificativă clinic în UTI depășește 900; NNT este necunoscut în cadrul non-UTI, dar este de așteptat să fie mult mai mare.9 într-un studiu retrospectiv de cohortă într-un spital academic, costurile de spitalizare pentru SUP în cadrul non-UCI au fost de 44.000 USD anual, iar costurile farmaciei ambulatorii au fost de aproape 68.000 USD când medicamentele au fost continuate post-descărcare, pentru o cheltuială anuală combinată estimată de aproape 112.000 USD.10 Acest lucru ar fi putut fi ușor prevenit.
în lumina acestor statistici, SUP continuă să fie supraprescrisă. Într-un sondaj transversal bazat pe Web, care evaluează cunoștințele, credințele și comportamentul medicilor cu privire la prescrierea SUP la pacienții care nu sunt ICU, temerile legate de sângerarea GI și repercusiunile legale ale ne prescrierii SUP au fost asociate cu un nivel mai ridicat de prescriere, în timp ce cunoașterea indicațiilor SUP și îngrijorarea cu privire la efectele secundare au fost asociate cu un comportament scăzut de prescriere.11 mai puțin de jumătate dintre medici ar putea identifica un singur efect secundar al terapiei PPI.11 mulți practicanți consideră aceste medicamente ca fiind inofensive, dar studiile au sugerat că terapia PPI și H2A este puternic asociată cu o probabilitate mai mare de infecție cu Clostridium difficile (CDI) și rate crescute de recurență.12,13 alte riscuri adesea trecute cu vederea asociate cu această terapie includ hipomagneziemie; deficit de vitamina B12; infecții respiratorii superioare, inclusiv pneumonie dobândită în comunitate (CAP) și pneumonie dobândită în spital (HAP); fracturi ale șoldului, coloanei vertebrale și încheieturilor; și absorbția modificată a medicamentelor dependente de pH.
riscurile terapiei
CDI: Toxina produsă de C difficile, o bacterie anaerobă, Formatoare de spori, gram-pozitivă, este o cauză majoră de diaree și colită la pacienții spitalizați, care a crescut în incidență, severitate și mortalitate în ultimii ani. Aproximativ 3 milioane de cazuri apar anual în SUA, iar costurile de îngrijire a sănătății depășesc 1,1 miliarde de dolari pe an.Colita pseudomembranoasă indusă de 14,15 c difficile are o rată a mortalității de 6% până la 30%.16 CDI a fost implicat în 20% până la 30% din toate cazurile de diaree asociată cu antibiotice, 50% până la 75% din cazurile de colită asociată cu antibiotice și mai mult de 90% din cazurile de colită pseudomembranoasă asociată cu antibiotice la pacienții spitalizați.17
în ciuda unui control mai bun al prescrierii antibioticelor și a îmbunătățirii igienei spitalicești, numărul cazurilor de CDI continuă să crească.18 diagnosticul îmbunătățit, tulpinile hipervirulente și o populație îmbătrânită ar fi putut contribui la acest lucru, dar acești factori nu explică pe deplin amploarea creșterilor recente.18 factori de risc comuni pentru CDI includ vârsta peste 65 de ani, spitalizarea curentă și recurentă, chirurgia GI recentă, imunosupresia, CDI anterioară, reședința într-un azil de bătrâni sau într-o unitate de îngrijire pe termen lung și utilizarea antibioticelor. Utilizarea antibioticelor este cel mai mare factor de risc pentru dezvoltarea CDI, dar adesea nu poate fi evitată la pacienții cu infecții. Un factor de risc mai puțin frecvent, dar mai modificabil, este utilizarea TSA la pacienții spitalizați la care aceste medicamente nu sunt indicate.
acidul Gastric este un mecanism nespecific de protecție împotriva agenților patogeni ingerați. Stomacul este în mod normal lipsit de bacterii, cu excepția Helicobacter pylori, care este echipat în mod unic pentru a face față acidității gastrice.19 C difficile se transmite prin ingestie, iar sporii săi relativ stabili cu acid continuă să germineze în intestinul subțire și colon. Celulele vegetative ale C difficile, spre deosebire de spori, sunt de obicei ucise în mediul cu pH scăzut al stomacului; cu toate acestea, s-a constatat că rămân viabile în conținutul gastric al pacienților care iau TSA. Cercetările efectuate pe modele animale au arătat că sporii c difficile se transformă în celule vegetative în decurs de 1 oră de la ingestie. Este plauzibil ca această transformare să apară în stomac dacă pH-ul este mai mare sau în cazul timpilor de tranzit gastric mai lenți.
mai multe studii au descoperit o asociere între utilizarea PPI sau H2A și CDI. Un studiu recent retrospectiv de cohortă a constatat că ICD recurentă a fost mai frecventă la pacienții expuși la IPP decât la pacienții neexpuși (25,2% față de 18,5%) și că utilizarea IPP în timpul tratamentului cu ICD a fost asociată cu un risc crescut de recurență cu 42%.12 pacienți expuși cu vârsta peste 80 de ani au avut cel mai mare risc.12 o analiză recentă a datelor din externările pacienților dintr-un centru medical terțiar pe o perioadă de 5 ani a constatat că riscul de CDI nosocomial a fost corelat pozitiv cu nivelul de supresie acidă și a fost cel mai mare la pacienții care au primit terapie PPI mai mult de o dată pe zi, sugerând un efect doză-răspuns asupra riscului de CDI nosocomial.13
pneumonie: Deși rezultatele investigațiilor au fost inconsistente, mai multe studii au descoperit o asociere între utilizarea TSA și un risc crescut de infecții ale tractului respirator și CAP. O revizuire sistematică recentă și meta-analiză au sugerat că utilizarea IPP și H2As este asociată cu un risc mai mare atât de PAC, cât și de HAP, estimând apariția unui caz de pneumonie pentru fiecare 200 de pacienți internați tratați cu TSA.20 având în vedere că 40% până la 70% dintre pacienții internați primesc TSA, amploarea morbidității și mortalității PAA poate fi pe deplin apreciată. Cea mai mare creștere a riscului de pneumonie asociată cu IPP a fost observată în prima săptămână de utilizare.20
ca și în cazul infecțiilor enterice, se crede că TSA crește riscul de pneumonie prin inhibarea secreției de acid gastric, permițând astfel supraaglomerarea bacteriană și colonizarea. Bacteriile pot fi apoi translocate în plămâni prin aspirație.20 la pacienții ventilați mecanic, colonizarea orofaringiană cu organisme gram-negative poate duce la colonizarea gastrică.19 o altă teorie este că adenozin trifosfataza de potasiu hidrogen este prezentă nu numai în celulele parietale ale stomacului, ci și în tractul respirator.20 inhibarea acestei enzime de către un IPP ar putea încuraja creșterea bacteriană în tractul respirator, ducând astfel la un risc crescut de pneumonie.20 în sfârșit, studiile in vitro au arătat că TSA poate afecta funcția neutrofilelor și activitatea celulelor ucigașe naturale.20
pacienții cu vârsta peste 65 de ani prezintă un risc crescut de pneumonie din cauza TSA. Nu numai că pacienții vârstnici sunt în general hipoclorici din cauza procesului de îmbătrânire, dar utilizarea PPI sau H2A este frecventă în acest grup; până la 5% iau aceste medicamente în mod regulat, iar un procent ridicat de pacienți vârstnici spitalizați primesc SUP.21 În plus, multe IPP și H2A nu necesită o rețetă, rezultând o utilizare crescută și nemonitorizată, adesea pentru perioade lungi de timp fără supraveghere medicală.21
alte riscuri: în plus față de CDI, alte infecții enterice—în special, din speciile Salmonella și Campylobacter—au fost asociate cu TSA. Atât Campylobacter, cât și Salmonella sunt microbi sensibili la acid. Infecțiile parazitare au fost legate și de suprimarea acidă, în special giardioza și strongiloidiaza.22 după cum s-a menționat anterior, acidul gastric este important în uciderea organismelor ingerate, dar un pH gastric crescut poate avea alte efecte negative asupra apărării gazdei GI, cum ar fi golirea gastrică întârziată, translocarea bacteriană crescută, scăderea vâscozității mucusului gastric și modificări ale florei microbiene normale.23
interacțiunile medicamentoase sunt o altă preocupare cu suprimarea acidului. Medicamentele cu absorbție dependentă de pH (adică digoxină, nifedipină, indinavir, midazolam, didanozină, alendronat, metadonă, aspirină) pot fi afectate atât de IPP, cât și de H2As, ducând la rate crescute de absorbție.9,24 de asemenea, mai multe medicamente au scăzut ratele de absorbție (de exemplu, ketoconazol, cefpodoximă, dipiridamol, atazanavir, itraconazol).24 există multe interacțiuni legate de CYP450 între IPP și alte medicamente. Interacțiunea potențială dintre IPP și clopidogrel a atras atenția din cauza posibilelor efecte adverse grave. O alertă de siguranță FDA din noiembrie 2009 a recomandat evitarea utilizării omeprazolului sau esomeprazolului cu clopidogrel, avertizând că interacțiunea mediată de CYP ar putea reduce eficacitatea clopidogrelului.22 din cauza datelor insuficiente, FDA nu a făcut recomandări specifice cu privire la alte IPP.22
au fost raportate mai multe cazuri de pacienți cu hipomagneziemie și hipokaliemie și hipocalcemie ulterioare care au prezentat simptome care pun viața în pericol și care necesită spitalizare. Majoritatea acestor cazuri au fost asociate cu utilizarea pe termen lung a IPP. Mecanismul acestui efect advers nu este cunoscut. La pacienții cu hipomagneziemie indusă de IPP, nu a apărut malabsorbție aparentă de magneziu sau risipă renală de magneziu.22 deși hipomagneziemia este rară, deoarece este atât de periculoasă pentru viață, furnizorii sunt încurajați să urmărească cu atenție hipomagneziemia inexplicabilă, hipokaliemia sau hipocalcemia la utilizatorii de IPP.22
utilizarea IPP timp de 12 luni sau mai mult a fost asociată cu deficit de vitamina B12, în special la pacienții vârstnici.9 aciditatea gastrică și pepsina permit eliberarea vitaminei B12 ingerate din starea sa legată de proteine; prin urmare, reducerea acidului gastric poate duce la malabsorbție și deficit de vitamina B12.22 rezultatele studiului au fost inconsistente și sunt necesare studii mai ample pentru a defini asocierea dintre utilizarea IPP și malabsorbția vitaminei B12 și deficiența ulterioară. Absorbția slabă a fierului alimentar a fost, de asemenea, legată de terapia PPI, dar datele actuale sunt slabe. Acidul Gastric facilitează absorbția fierului nonheme prin reducerea fierului feric la forma feroasă mai solubilă și, de asemenea, îmbunătățește disocierea fierului-sare de alimentele ingerate.22 există mai multe rapoarte de caz, dar nu au fost efectuate studii prospective în acest domeniu.
utilizarea IPP pe termen lung a fost asociată cu o incidență crescută a fracturilor. Mecanismele posibile includ scăderea absorbției calciului într-un mediu gastric mai alcalin și afectarea remodelării osoase datorită scăderii activității osteoclastelor, ceea ce duce la repararea microfracturii inhibate.22 încă o dată, studiile sunt inconsistente, dar dovezile existente au fost suficiente pentru a determina FDA să revizuiască etichetarea PPI în mai 2010 pentru a include noi informații de siguranță despre posibilul risc crescut de fracturi ale șoldului, încheieturii mâinii și coloanei vertebrale.22 riscul de fractură poate fi mai semnificativ clinic la pacienții cu osteoporoză sau alți factori de risc pentru fractură, cum ar fi utilizarea steroizilor. Medicii sunt încurajați să cântărească riscurile și beneficiile utilizării IPP la pacienții vulnerabili. Dacă suplimentele de calciu sunt prescrise utilizatorilor de IPP, acestea ar trebui să fie într-o formă solubilă, cum ar fi citratul, mai degrabă decât carbonatul.22
utilizare adecvată
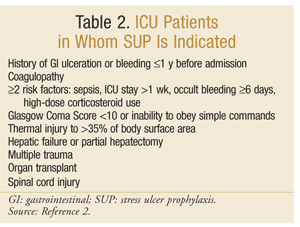
Societatea Americană a Farmaciștilor din Sistemul de sănătate a elaborat una dintre cele mai cuprinzătoare linii directoare bazate pe dovezi pentru SUP. Orientările terapeutice actuale au fost publicate în 1999, cu o actualizare în curs de desfășurare la această scriere.25 SUP nu este recomandat pacienților non-UTI; profilaxia este recomandată numai pacienților cu UTI care necesită ventilație mecanică mai mult de 48 de ore, au antecedente de ulcerații GI sau sângerări în decurs de 1 an înainte de admitere sau care au coagulopatie. Profilaxia este, de asemenea, recomandată pentru pacienții cu terapie intensivă cu cel puțin doi dintre următorii factori de risc: sepsis, șederea la terapie intensivă care depășește 1 săptămână, sângerări oculte care durează 6 zile sau mai mult și utilizarea corticosteroizilor cu doze mari (hidrocortizon >250 mg/zi sau echivalent). În plus, SUP este recomandat pentru populațiile speciale de terapie intensivă, cum ar fi pacienții cu un scor de comă Glasgow <10 (sau incapacitatea de a respecta comenzi simple), leziuni termice la >35% din suprafața corporală, insuficiență hepatică sau hepatectomie parțială, traume multiple, transplanturi sau leziuni ale măduvei spinării.2 recomandările sunt rezumate în tabelul 2.
concluzie: rolul farmacistului
eforturile clinicienilor de a reduce utilizarea TSA la pacienții non-UTI pot preveni morbiditatea semnificativă a pacienților și pot reduce atât costurile spitalicești, cât și costurile pentru sistemul general de îngrijire a sănătății. Este important să cântăriți cu atenție riscurile și beneficiile TSA înainte de a utiliza aceste medicamente în spital. O atenție specială trebuie acordată pacienților deja expuși riscului de pneumonie, cum ar fi vârstnicii, cei cu boli pulmonare cronice și cei care iau imunosupresoare. Trebuie depuse toate eforturile pentru a evalua critic terapia de suprimare a acidului la pacienții internați și pentru a întrerupe terapia ori de câte ori este posibil. Când este indicată SUP, pacientul trebuie să primească cea mai mică doză posibilă.
farmaciștii pot ajuta la stoparea utilizării TSA prin identificarea pacienților cărora li se prescriu în mod necorespunzător aceste medicamente și pot fi esențiali în educarea medicilor cu privire la pacienții care ar trebui să primească SUP. Farmaciștii implicați în procesarea medicamentelor de descărcare de gestiune pot ajuta la asigurarea faptului că pacienții nu sunt trimiși acasă pe terapie de supresie acidă fără o indicație adecvată. Din păcate, măsurile luate pentru prevenirea ulcerelor de stres la pacienții spitalizați au creat o nouă problemă și, lucrând împreună, echipa de îngrijire a sănătății poate ajuta la prevenirea morbidității inutile prin aplicarea recomandărilor de orientare la instituția lor.
1. Spirt MJ. Boala mucoasei legate de stres: factori de risc și terapie profilactică. Clin Ther. 2004;26:197-213.
2. ASHP orientări terapeutice privind profilaxia ulcerului de stres. Comisia ASHP pentru terapie și aprobată de Consiliul de Administrație al ASHP la 14 noiembrie 1998. Am J Sănătate Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, Walter SD și colab. Mortalitatea atribuibilă și durata șederii unității de terapie intensivă a sângerărilor gastrointestinale importante din punct de vedere clinic la pacienții cu afecțiuni critice. Crit Care. 2001;5:368-375.
4. Bucătar DJ, Fuller HD, Guyatt GH și colab. Factori de risc pentru sângerarea gastrointestinală la pacienții cu afecțiuni critice. Canadian Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. obiective terapeutice și opțiuni de tratament pentru prevenirea sindromului ulcerului de stres. Sunt J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth noi. Hemoragie gastrointestinală la pacienții dintr-o unitate de terapie intensivă respiratorie. Piept. 1977;72:301-304.
7. Sesler JM. Boala mucoasei legate de stres în unitatea de terapie intensivă: o actualizare a profilaxiei. AACN Adv Crit îngrijire. 2007;18:119-128.
8. Grube RR, mai DB. Profilaxia ulcerului de stres la pacienții spitalizați care nu se află în unitățile de terapie intensivă. Am J Sănătate Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Suprautilizarea inhibitorilor pompei de protoni: o revizuire a rentabilității și a riscului în PPI. Am J Gastroenterol. 2009; 104 (supliment 2):S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Amploarea și impactul economic al utilizării necorespunzătoare a profilaxiei ulcerului de stres la pacienții spitalizați non-UTI. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain s, Stefan M, Visintainer P, Rothberg M. de ce medicii prescriu profilaxia ulcerului de stres la pacienții cu Medicină Generală? Sud Med J. 2010; 103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV și colab. Inhibitorii pompei de protoni și riscul de infecție recurentă cu Clostridium difficile. Arch Intern Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P și colab. Supresia acidului gastric iatrogenic și riscul de infecție nosocomială cu Clostridium difficile. Arch Intern Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Costurile de îngrijire a sănătății și mortalitatea asociată cu diareea nosocomială datorată clostridum difficile. Clin Infectează Dis. 2002;34:346-353.
15. Schroeder dna Clostridium difficile–diaree asociată. Sunt Medic De Familie. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: descoperiri epidemiologice recente și progrese în terapie. Farmacoterapie. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Colita Clostridium difficile. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. utilizarea excesivă a inhibitorilor pompei de protoni alimentează epidemia actuală de diaree asociată cu Clostridium difficile? J Hosp Infecta. 2008;70:1-6.
19. Vakil N. inhibarea acidului și infecțiile în afara tractului gastro-intestinal. Am J Gastroenterol. 2009; 104: S17-S20.
20. Eom CS, Jeon CY, Lim JW și colab. Utilizarea medicamentelor supresive acide și riscul de pneumonie: o revizuire sistematică și meta-analiză. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH și colab. Pneumonie recurentă dobândită în comunitate la pacienții care încep medicamente care suprimă acidul. Sunt J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. efecte Adverse asupra terapiei inhibitoare a pompei de protoni pe termen lung. Dig Dis Sci. 2011;56:931-950.
23. Dial ms. utilizarea inhibitorului pompei de protoni și infecțiile enterice. Am J Gastroenterol. 2009; 104 (supliment 2):S10-S16.
24. Lahner e, Annibale B, Della Fave G. revizuire sistematică: absorbția afectată a medicamentului legată de administrarea concomitentă a terapiei antisecretorii. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. Societatea americană a Farmaciștilor din Sistemul de sănătate. Terapeutice guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. accesat la 19 septembrie 2011.