ストレス潰瘍の予防:過度の使用と誤用の結果
私たちのPharm。 2011;36(10):73-76.
米国の病院に入院したほぼすべての患者は、ストレス潰瘍予防(SUP)としてプロトンポンプ阻害剤(PPI)またはヒスタミン2拮抗薬(H2A)のいずれかを処方されているようである。 ストレス潰瘍は、重篤な病気または重度の傷害を有する患者に発症する胃粘膜びらんである。 前庭部または十二指腸に発生する傾向がある消化性潰瘍とは異なり、ストレス関連の粘膜損傷は、典型的には胃の酸産生領域(すなわち、体および眼底)1ストレス性潰瘍は、消化性潰瘍とは異なり、消化管(GI)出血を引き起こす傾向があり、腹痛と関連していない。 ストレス関連粘膜損傷の粘膜変化は、主に出血を引き起こさないが、出血を引き起こすより深い潰瘍に発展する可能性のある小さなびらんを伴う。
酸過分泌を含むいくつかの要因がストレス潰瘍形成に寄与する; 粘液および重炭酸塩の分泌のような正常な防御機構の変化;アラキドン酸の代謝物質、cytokinesおよび酸素の遊離基のような仲介者の解放;およびGIシステム2これらのびらんは、迅速に(入院の£24時間)発生するか、または発症するのに時間がかかる(>10-14日)。2ストレス潰瘍および関連する出血は、重症患者において有意な罹患率および死亡率を引き起こす。 ある研究では、GI出血の重症患者では46%、出血のない患者では21%の死亡率が報告されています(P<。001).3他の研究では、この高い死亡率が確認されています。4,5
大規模な研究では、ストレス関連の消化管出血の最も強い危険因子は、長期の機械的換気および凝固障害であることが示されている。4危険はICUの滞在の機械換気そして長さの日数の増加すると増加します。6その他の危険因子には、最近の大手術、大外傷、重度の火傷、頭部外傷、入院時の肝臓または腎臓疾患、敗血症、および低血圧が含まれる。1表1は、リスク要因の完全なリストを提供します。

予防療法
明らかなストレス関連粘膜出血のリスクを軽減するのに非常に効果的であることが証明されていますが、予防療法だけでは全体的な死亡率を低下させることはありません。さらに、SupとしてのPpiまたはH2Asの処方は、文献およびクリティカルケア集団のためのガイドラインによって支持されている。 近年、非ICU患者におけるSUPの使用(しばしば適応症なし)が増加している。 複数の研究では、酸抑制薬(ASDs)の過剰使用が実証されています。; 入院した患者の71%がAsdを処方されており、多くはこれらの薬剤で誤って排出されています。8多くの患者が地域社会で不適切にAsdを処方されており、入院中にこれらの薬を中止することはほとんど行われていません。 さらに、gastroesophageal還流の病気(GERD)の徴候を扱うために投薬する毎日二度PPIの患者は頻繁に単一日線量療法に無症候性なら歩んでいません。9
Asdの過剰使用と誤用は、患者に危害を与え、医療システムのコストを増加させる可能性がある。 ICUでの臨床的に有意なGI出血の単一のエピソードを防ぐために治療するのに必要な数(NNT)は900を超えています;NNTは非ICU設定では不明ですが、はるかに高9学術病院でのレトロスペクティブコホート研究では、ICU以外の環境でのSUPの入院費は年間44,000ドルであり、退院後に薬を継続した場合の外来薬局費は68,000ドル近くであり、年間推定支出は112,000ドル近くであった10。
これらの統計に照らして、SUPは引き続き過剰処方されています。 非ICU患者におけるSUPの処方に関する医師の知識、信念、行動を評価する横断的なWebベースの調査では、GI出血に対する恐怖とSUPを処方しないことの法的影響は、より高い処方レベルと関連していたが、SUPの適応症に関する知識と副作用に関する懸念は低い処方行動と関連していた。11医師の半数以下がPPI療法の単一の副作用を特定することができました。11多くの開業医は無害としてこれらの薬剤を見ますが、調査はPPIおよびH2A療法がClostridiumのdifficile伝染(CDI)および高められた再発率のより大きい可能性と強く関連していることを提案しました。12,13この療法と関連付けられる他の頻繁に見落とされた危険はhypomagnesemiaを含んでいます;ビタミンB12の不足;コミュニティ後天性肺炎(CAP)および病院後天性肺炎(HAP)を含む上気道の伝染、;ヒップ、脊柱および手首のひび;およびpH依存した薬物の変えられた吸収。
: 嫌気性、胞子形成性、グラム陽性細菌であるC difficileによって産生される毒素は、近年、発生率、重症度、および死亡率が増加している入院患者における下痢およ 米国では年間約300万件が発生し、医療費は年間11億ドルを超えています。14,15Cディフィシル誘発性偽膜性大腸炎は、6%から30%の死亡率を有する。16CDIは、抗生物質関連下痢のすべての症例の20%-30%、抗生物質関連大腸炎の症例の50%-75%、および入院患者における抗生物質関連偽膜性大腸炎の症例の90%以上に関17
抗生物質の処方のより良い制御と病院の衛生の改善にもかかわらず、CDI症例の数は上昇し続けている。18診断の改善、高病原性株、および高齢化がこれに寄与している可能性があるが、これらの要因は、最近の増加の程度を完全に説明するものではない。18CDIの一般的な危険因子には、65歳以上の年齢、現在および再発入院、最近のGI手術、免疫抑制、以前のCDI、特別養護老人ホームまたは長期ケア施設に居住、およ 抗生物質の使用は、CDIの開発のための最大の危険因子であるが、それは多くの場合、感染症の患者では回避することはできません。 あまり一般的ではないが、より変更可能な危険因子は、これらの薬物が示されていない入院患者におけるASDsの使用である。
胃酸は、摂取された病原体に対する非特異的防御機構である。 胃は独特に胃の酸味を取扱うために装備されているHelicobacterの幽門を除いて細菌が、普通ない。19C difficileは摂取によって送信され、比較的酸安定な胞子は小腸およびコロンで発芽することを続きます。 C difficileの生長する細胞は、胞子とは違って、通常胃の低pHの環境で殺されます;但し、ASDsを取っている患者の胃の内容物に実行可能残るためにありました。 動物モデルの研究はcのdifficile胞子が摂取の1時間以内の生長する細胞に変形することを示しました。 この形質転換は、pHがより高い場合、またはより遅い胃通過時間の場合には、胃において起こり得ることがもっともらしい。
いくつかの研究で、PPIまたはH2Aの使用とCDIの間に関連性があることが判明している。 最近のレトロスペクティブコホート研究では、再発CDIは未露光患者(25.2%対18.5%)よりもPpiにさらされた患者でより一般的であり、CDI治療中のPPIの使用は42%12歳以上の80歳の暴露された患者は、最も高いリスクを有していた。12 5年間にわたる三次医療センターからの患者放電からのデータの最近の分析は、院内CDIのリスクは、酸抑制のレベルと正の相関があり、PPI療法を毎日一度以上受けている患者で最も高く、院内CDIのリスクに対する用量応答効果を示唆していることを見出した。13
: 調査の結果は一貫性がありませんでしたが、いくつかの研究では、Asdの使用と気道感染症およびCAPのリスクの増加との関連が見出されています。 最近の系統的レビューとメタアナリシスは、PpiとH2Asの使用がCAPとHAPの両方のより大きなリスクと関連しており、ASDsで治療された200人の入院患者ごとに肺炎の1例の発生を推定していることを示唆しています。20入院患者の40%から70%がAsdを受けることを考慮すると、HAPの罹患率および死亡率の大きさを十分に評価することができる。 Ppiに関連する肺炎のリスクの最大の増加は、使用の最初の週に観察された。20
腸内感染症と同様に、Asdは胃酸の分泌を阻害し、細菌の過増殖とコロニー形成を可能にすることによって肺炎のリスクを高めると考えられている。 次いで、吸引によって細菌を肺に移動させることができる。20機械的に換気された患者では、グラム陰性生物による口腔咽頭のコロニー形成は胃のコロニー形成につながる可能性がある。19別の理論は、水素カリウムアデノシントリホスファターゼは、胃の壁細胞だけでなく、気道にも存在するということです。従ってPPIによるこの酵素の阻止は呼吸器管の細菌の成長を励ますことができ肺炎の高められた危険の原因となります。最後に、in vitro研究では、Asdsが好中球の機能およびナチュラルキラー細胞の活性を損ない得ることが示されている。20
65歳以上の患者は、ASDsによる肺炎のリスクが高い。 高齢の患者は、老化プロセスのために一般的に次亜塩素酸であるだけでなく、PPIまたはH2Aの使用がこのグループで一般的であり、最大5%がこれらの薬を定期的に服用し、入院した高齢の患者の割合が高いSUPを受けている。21さらに、多くのPpiおよびH2Asは処方箋を必要とせず、その結果、多くの場合、医師の監督なしに長期間にわたって、増加し、監視されない使用をもたらす。21
その他のリスク:CDIに加えて、他の腸内感染、特にサルモネラおよびカンピロバクター種からの感染がASDsと関連している。 カンピロバクターとサルモネラの両方が酸感受性微生物である。 寄生虫感染症は、酸抑制、特にジアルジア症および強直性感染症にも関連している。22前述のように、胃酸は摂取された生物の殺害において重要であるが、上昇した胃pHは、胃排出の遅延、細菌転座の増加、胃粘液粘度の低下、および正常な微生物叢の変化など、GI宿主防御に対して他の負の効果を有する可能性がある。23
薬物相互作用は、酸抑制のもう一つの懸念事項です。 PH依存性吸収(すなわち、ジゴキシン、ニフェジピン、インジナビル、ミダゾラム、ジダノシン、アレンドロネート、メタドン、アスピリン)を有する薬物は、PPIsおよびh2Asの両方に影響され、吸収速度が増加する可能性がある。9,24同様に、複数の薬剤は吸収の率を減らしました(すなわち、ketoconazole、cefpodoxime、dipyridamole、atazanavir、itraconazole)。Ppiと他の薬物との間には、多くのCYP450関連の相互作用がある。 Ppiとクロピドグレルとの間の潜在的な相互作用は、重篤な副作用の可能性のために注目を集めている。 2009年11月のFDAの安全警報はCYP仲介された相互作用がclopidogrelの有効性を減らすことができることを警告するclopidogrelとのomeprazoleかesomeprazoleの使用を避けることを推薦しました。22データが不十分であるため、FDAは他のPpiに関する具体的な勧告を行っていない。22
入院を必要とする生命を脅かす症状を呈した低マグネシウム血症およびその後の低カリウム血症および低カルシウム血症の患者のいくつかの症例が報告されている。 これらの症例のほとんどは、長期PPI使用と関連していた。 この悪影響のメカニズムは不明である。 PPI誘発性低マグネシウム血症の患者では、明らかなマグネシウム吸収不良または腎マグネシウム消耗は起こらなかった。22低マグネシウム血症はまれであるが、生命を脅かすプロバイダーは、PPIユーザーにおける原因不明の低マグネシウム血症、低カリウム血症、または低カルシウム血症を慎重に監視することが奨励されているためである。22
Ppiを12ヶ月以上使用すると、特に高齢の患者ではビタミンB12欠乏症と関連しています。9胃の酸性度とペプシンは、そのタンパク質結合状態から摂取されたビタミンB12の放出を可能にする; 従って、胃の酸の減少は吸収不良およびビタミンB12の不足の原因となるかもしれません。22の研究結果は矛盾しており、PPIの使用とビタミンB12吸収不良およびその後の欠乏との関連を定義するためには、より大きな研究が必要である。 食事中の鉄の吸収不良もPPI療法に関連していますが、現在のデータは弱いです。 胃酸は、第二鉄をより可溶性の第一鉄形態に還元することによって非ヘム鉄の吸収を促進し、また摂取された食品からの鉄-塩解離を促進する。22いくつかの症例報告が存在するが、この分野で前向き研究は行われていない。
PPIの長期使用は骨折の発生率の増加と関連している。 可能なメカニズムは抑制されたmicrofracture修理をもたらす減らされた破骨細胞の活動による骨の改造のアルカリ胃の環境そして減損のカルシウムの減22もう一度、研究は矛盾していますが、既存の証拠は、股関節、手首、および背骨の骨折のリスクの増加の可能性に関する新しい安全性情報を含めるために、2010年にPPIラベリングを改訂するようFDAに促すのに十分であった。22骨折のリスクは、骨粗鬆症またはステロイド使用などの骨折の他の危険因子を有する患者において、より臨床的に有意であり得る。 医師は、脆弱な患者におけるPPIの使用のリスクと利点を比較検討することが奨励されています。 カルシウム補足がPPIのユーザーに規定されれば、炭酸塩よりもむしろクエン酸塩のような溶ける形態に、あるべきです。22
適切な使用
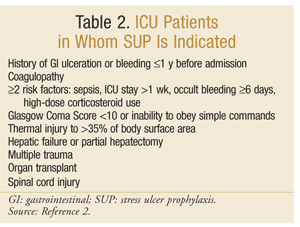
アメリカ保健システム薬剤師協会は、SUPのための最も包括的な証拠に基づくガイドラインの一つを開発しました。 現在の治療ガイドラインは、この執筆時点で進行中の更新で、1999年に公開されました。25SUPは非ICU患者には推奨されません; 予防は、48時間以上の機械的換気を必要とするICU患者、入院前1年以内にGI潰瘍または出血の病歴を有する、または凝固障害を有するICU患者にのみ推 予防法はまた次の危険率の少なくとも2のICUの患者のために助言されます:敗血症、1週を超過するICUの滞在、6日または多くを持続させる潜在的な出血、および高用量の副腎皮質ホルモン(ヒドロコルチゾン>250mg/dayまたは等量)の使用。 さらに、Supは、グラスゴー昏睡スコア<10(または単純なコマンドに従うことができない)、体表面積の>35%への熱損傷、肝不全または部分肝切除、多発性外傷、移植、ま2推奨事項を表2にまとめます。
結論:薬剤師の役割
非ICU患者におけるAsdの使用を抑制するための臨床医の努力は、有意な患者の罹患率を防止し、病院のコストと医療システム全体 入院患者の設定でこれらの薬物を使用する前に注意深くASDsの危険そして利点の重量を量ることは重要です。 高齢者、慢性肺疾患の患者、免疫抑制剤を服用している患者など、すでに肺炎のリスクがある患者には特別な配慮を払う必要があります。 入院患者の酸抑制療法を批判的に評価し、可能な限り治療を中止するためにあらゆる努力を払うべきである。 SUPが示されている場合、患者は可能な限り最低用量を受けるべきである。
薬剤師は、これらの薬を不適切に処方されている患者を特定することによってAsdの使用を止めるのを助けることができ、どの患者がSUPを受けるべきか 排出の薬物の処理にかかわる薬剤師は患者が適切な徴候なしで酸抑制療法で家に送られないことを保障するのを助けることができます。 残念ながら、入院患者のストレス潰瘍を予防するために取られた措置は、新たな問題を作成しており、医療チームと協力することにより、彼らの施設でガイ
1. Spirt MJ. ストレス関連粘膜疾患:危険因子および予防的治療。 クリン-サー 2004;26:197-213.
2. ストレス潰瘍予防に関するASHP治療ガイドライン。 治療上のASHP委員会とNovember14、1998にASHP取締役会によって承認されました。 Am J Health Syst Pharm. 1999;56:347-379.
3. クックDJ、グリフィスLE、ウォルター SD、et al. 重症患者における臨床的に重要な消化管出血の集中治療室滞在の起因する死亡率および長さ。 クリティカルケア 2001;5:368-375.
4. クックDJ、フラー HD、Guyatt GH、et al. 重症患者における消化管出血の危険因子。 カナダの救急救命士。 N Engl J Med. 1994;330:377-381.
5. Zuckerman GR、Shuman R.ストレス潰瘍症候群の予防のための治療目標および治療選択肢。 Am J Med. 1987;83:29-35.
6. ハリスSK、骨RC、ルース私たち。 呼吸集中治療室の患者における胃腸出血。 胸。 1977;72:301-304.
7. Sesler JM. 集中治療室におけるストレス関連粘膜疾患:予防に関する更新。 AACN Adv Critケア. 2007;18:119-128.
8. グルーブRR、メイDB。 集中治療室ではない入院患者におけるストレス潰瘍予防。 Am J Health Syst Pharm. 2007;64:1396-1400.
9. ハイデルボー JJ、ゴールドバーグKL、インナトミJM。 プロトンポンプ阻害剤の過剰利用:PPIにおける費用対効果とリスクのレビュー。 アム-ジョイ-ジョイ-ジョイ 2009;104(suppl2):S27-S32.
10. ハイデルボー JJ、インナトミJM。 非ICU入院患者におけるストレス潰瘍予防の不適切な使用の大きさおよび経済的影響。 アム-ジョイ-ジョイ-ジョイ 2006;101:2200-2205.
11. Hussain S、Stefan M、Visintainer P、Rothberg M.なぜ医師は一般的な医学患者にストレス潰瘍予防を処方するのですか? 南Med J.2010;103:1103-1110.
12. Linsky A,Gupta K,Lawler EV,et al. 再発Clostridium difficile伝染のためのプロトンポンプ抑制剤そして危険。 アーチインターンメッド. 2010;170:772-778.
13. Howell M D,Novack V,Grgurich P,et a l. 医原性胃酸抑制および院内クロストリジウム-ディフィシル感染のリスク。 アーチインターンメッド. 2010;170:784-790.
14. Kyne L,Hamel MB,Polavaram R,Kelly CP. Clostridum difficileによる院内下痢に関連する医療費および死亡率。 クリニークDis. 2002;34:346-353.
15. シュレーダー氏クロストリジウムdifficile関連下痢。 アムファム医師。 2005;71:921-928.
16. McMaster-Baxter NL,Musher DM. Clostridium difficile:最近の疫学的所見と治療の進歩。 薬物療法。 2007;27:1029-1039.
17. ケリー CP、ポトゥーラキスC、ラモントJT。 クロストリジウム-ディフィシル大腸炎 N Engl J Med. 1994;330:257-262.
18. Cunningham R、ダイヤルS.プロトンポンプ抑制剤の過剰使用はClostridiumのdifficile準の下痢の現在の伝染病に燃料を供給しているか。 J-ホスプ-ド-ラ-ラ-ラ 2008;70:1-6.
19. Vakil N.胃腸管外の酸阻害および感染症。 アム-ジョイ-ジョイ-ジョイ 2009;104:S17-S20.
20. Eom CS,Jeon CY,Lim JW,et al. 酸抑制薬の使用と肺炎のリスク:系統的レビューとメタ分析。 CMAJ。 2011;183:310-319.
21. Eurich DT,Sadowski CA,Simpson SH,et al. 酸抑制薬を開始する患者における再発性コミュニティ後天性肺炎。 Am J Med. 2010;123:47-53.
22. Sheen E,Triadafilopoulos G.長期プロトンポンプ阻害剤療法への悪影響. ディグ-ディス-サイ… 2011;56:931-950.
23. ダイアルさんプロトンポンプ阻害剤の使用と腸内感染症。 アム-ジョイ-ジョイ-ジョイ 2009;104(suppl2):S10-S16.
24. Lahner E、Annibale B、Della Fave G.システマティックレビュー:抗分泌療法の同時投与に関連する薬物吸収の障害。 Aliment Pharmacol Ther. 2009;29:1219-1229.
25. アメリカ保健システム薬剤師協会。 治療guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx.アクセスSeptember19,2011.