Stressulkus-Prophylaxe: Die Folgen von Überbeanspruchung und Missbrauch
In: US Pharm. 2011;36(10):73-76.
Es scheint, als ob fast jedem Patienten, der in den Vereinigten Staaten ins Krankenhaus eingeliefert wird, entweder ein Protonenpumpenhemmer (PPI) oder ein Histamin-2-Antagonist (H2A) als Stressulkus-Prophylaxe (SUP) verschrieben wird. Stressgeschwüre sind Magenschleimhauterosionen, die sich bei Patienten mit schwerer Krankheit oder schwerer Verletzung entwickeln können. Im Gegensatz zu Magengeschwüren, die dazu neigen, sich im Antrum oder Zwölffingerdarm zu entwickeln, treten stressbedingte Schleimhautverletzungen typischerweise in den säureproduzierenden Bereichen des Magens (d. H. Korpus und Fundus) auf.1 Stressgeschwüre neigen im Gegensatz zu Magengeschwüren dazu, gastrointestinale Blutungen (GI) zu verursachen, und sind nicht mit Bauchschmerzen verbunden. Die Schleimhautveränderungen einer stressbedingten Schleimhautverletzung betreffen hauptsächlich kleine Erosionen, die nicht zu Blutungen führen, sich aber zu tieferen Geschwüren entwickeln können, die Blutungen verursachen.
Mehrere Faktoren tragen zur Bildung von Stressgeschwüren bei, einschließlich saurer Hypersekretion; veränderung normaler Schutzmechanismen wie Schleim- und Bikarbonatsekrete; Freisetzung von Mediatoren wie Arachidonsäuremetaboliten, Zytokinen und freien Sauerstoffradikalen; und Ischämie des GI-Systems.2 Diese Erosionen können schnell auftreten (£ 24 Stunden nach Aufnahme) oder länger dauern (> 10-14 Tage).2 Stressgeschwüre und damit verbundene Blutungen verursachen bei kritisch kranken Patienten eine signifikante Morbidität und Mortalität. Eine Studie berichtete über eine Sterblichkeitsrate von 46% bei kritisch kranken Patienten mit GI-Blutungen im Vergleich zu 21% bei Patienten ohne Blutung (P <.001).3 Weitere Studien haben diese hohe Sterblichkeitsrate bestätigt.4,5
Große Studien haben gezeigt, dass die stärksten Risikofaktoren für stressbedingte GI-Blutungen eine verlängerte mechanische Beatmung und Koagulopathie sind.4 Das Risiko steigt mit zunehmender Anzahl von Tagen mechanischer Beatmung und Dauer des Intensivaufenthalts.6 Weitere Risikofaktoren sind kürzlich durchgeführte größere Operationen, schwere Traumata, schwere Verbrennungen, Kopftraumata, Leber- oder Nierenerkrankungen bei Aufnahme, Sepsis und Hypotonie.1 TABELLE 1 enthält eine vollständige Liste der Risikofaktoren.

Prophylaktische Therapie
Obwohl sich das Risiko für offene und klinisch wichtige stressbedingte Schleimhautblutungen als hochwirksam erwiesen hat, verringert die prophylaktische Therapie allein die Gesamtmortalitätsrate nicht.7 Dennoch wird die Verschreibung von PPIs oder H2As als SUP durch die Literatur und durch Richtlinien für die Intensivpopulation unterstützt. In den letzten Jahren hat der Einsatz von SUP bei Nicht-Intensivpatienten — oft ohne Indikation — zugenommen. Mehrere Studien haben den übermäßigen Gebrauch von säureunterdrückenden Medikamenten (ASDs) gezeigt; bis zu 71% der aufgenommenen Patienten werden ASDs verschrieben, wobei viele fälschlicherweise mit diesen Mitteln entlassen werden.8 Vielen Patienten werden in der Gemeinde unangemessen ASDs verschrieben, und es wird wenig unternommen, um diese Medikamente während des Krankenhausaufenthalts abzusetzen. Darüber hinaus werden Patienten mit zweimal täglicher PPI-Dosierung zur Behandlung von Symptomen der gastroösophagealen Refluxkrankheit (GERD) häufig nicht auf eine Therapie mit einer einzigen Tagesdosis reduziert, sobald sie asymptomatisch sind.9
Der übermäßige Gebrauch und Missbrauch von ASDs kann zu Patientenschäden und erhöhten Kosten für das Gesundheitssystem führen. Die Anzahl, die zur Behandlung (NNT) benötigt wird, um eine einzelne Episode klinisch signifikanter GI-Blutungen auf der Intensivstation zu verhindern, übersteigt 900; Die NNT ist in der Nicht-INTENSIVSTATION unbekannt, wird aber voraussichtlich viel höher sein.9 In einer retrospektiven Kohortenstudie in einem akademischen Krankenhaus beliefen sich die stationären Kosten für SUP auf der Nicht-Intensivstation auf 44.000 USD pro Jahr und die ambulanten Apothekenkosten auf fast 68.000 USD, wenn die Medikamente nach der Entlassung fortgesetzt wurden, für eine kombinierte jährliche geschätzte Ausgabe von fast 112.000 USD.10 Dies hätte leicht verhindert werden können.
Angesichts dieser Statistiken wird SUP weiterhin überbewertet. In einer webbasierten Querschnittsumfrage, in der das Wissen, die Überzeugungen und das Verhalten von Ärzten in Bezug auf die Verschreibung von SUP bei Nicht-Intensivpatienten bewertet wurden, waren Ängste vor GI-Blutungen und die rechtlichen Auswirkungen der Nichtverschreibung von SUP mit einem höheren Verschreibungsniveau verbunden, während das Wissen über SUP-Indikationen und die Besorgnis über Nebenwirkungen mit einem niedrigen Verschreibungsverhalten verbunden waren.11 Weniger als die Hälfte der Ärzte konnte eine einzige Nebenwirkung der PPI-Therapie feststellen.11 Viele Praktiker betrachten diese Medikamente als harmlos, aber Studien haben gezeigt, dass die PPI- und H2A-Therapie stark mit einer größeren Wahrscheinlichkeit einer Clostridium difficile-Infektion (CDI) und erhöhten Rezidivraten verbunden ist.12,13 Andere oft übersehene Risiken im Zusammenhang mit dieser Therapie sind Hypomagnesiämie; Vitamin B12-Mangel; Infektionen der oberen Atemwege, einschließlich ambulant erworbener Pneumonie (CAP) und im Krankenhaus erworbener Pneumonie (HAP); Frakturen der Hüfte, Wirbelsäule und Handgelenke; und veränderte Absorption von pH-abhängigen Medikamenten.
Therapierisiken
CDI: Das von C difficile, einem anaeroben, sporenbildenden, grampositiven Bakterium, produzierte Toxin ist eine Hauptursache für Durchfall und Kolitis bei Krankenhauspatienten, deren Inzidenz, Schweregrad und Mortalität in den letzten Jahren zugenommen haben. Ungefähr 3 Millionen Fälle treten jährlich in den USA auf, und die Kosten für das Gesundheitswesen übersteigen 1.1 Milliarden US-Dollar pro Jahr.14,15 C difficile-induzierte pseudomembranöse Kolitis hat eine Mortalitätsrate von 6% bis 30%.16 CDI wurde in 20% bis 30% aller Fälle von Antibiotika-assoziierter Diarrhoe, 50% bis 75% der Fälle von Antibiotika-assoziierter Kolitis und mehr als 90% der Fälle von Antibiotika-assoziierter pseudomembranöser Kolitis bei Krankenhauspatienten in Verbindung gebracht.17
Trotz besserer Kontrolle der Verschreibung von Antibiotika und Verbesserungen der Krankenhaushygiene steigt die Zahl der CDI-Fälle weiter an.18 Eine verbesserte Diagnose, hypervirulente Stämme und eine alternde Bevölkerung mögen dazu beigetragen haben, aber diese Faktoren erklären das Ausmaß der jüngsten Zunahme nicht vollständig.18 Häufige Risikofaktoren für CDI sind Alter über 65 Jahre, aktuelle und wiederkehrende Krankenhausaufenthalte, kürzliche GI-Operationen, Immunsuppression, frühere CDI, Aufenthalt in einem Pflegeheim oder einer Langzeitpflegeeinrichtung und Antibiotikaeinsatz. Der Einsatz von Antibiotika ist der größte Risikofaktor für die Entwicklung von CDI, kann jedoch bei Patienten mit Infektionen häufig nicht vermieden werden. Ein weniger häufiger, aber modifizierbarer Risikofaktor ist die Verwendung von ASDs bei Krankenhauspatienten, bei denen diese Medikamente nicht indiziert sind.
Magensäure ist ein unspezifischer Schutzmechanismus gegen aufgenommene Krankheitserreger. Der Magen ist normalerweise frei von Bakterien, mit Ausnahme von Helicobacter pylori, das einzigartig für den Umgang mit Magensäure ausgestattet ist.19 C difficile wird durch Verschlucken übertragen, und seine relativ säurestabilen Sporen keimen im Dünndarm und Dickdarm weiter. Die vegetativen Zellen von C difficile werden im Gegensatz zu den Sporen normalerweise in der Umgebung mit niedrigem pH-Wert des Magens abgetötet; Es wurde jedoch festgestellt, dass sie im Mageninhalt von Patienten, die ASDs einnehmen, lebensfähig bleiben. Untersuchungen an Tiermodellen haben gezeigt, dass sich C-Difficile-Sporen innerhalb von 1 Stunde nach der Einnahme in vegetative Zellen verwandeln. Es ist plausibel, dass diese Umwandlung im Magen auftreten kann, wenn der pH-Wert höher ist oder wenn die Magentransitzeiten langsamer sind.
Mehrere Studien haben einen Zusammenhang zwischen der Verwendung von PPI oder H2A und CDI gefunden. Eine kürzlich durchgeführte retrospektive Kohortenstudie ergab, dass rezidivierende CDI bei Patienten, die PPI ausgesetzt waren, häufiger auftraten als bei nicht exponierten Patienten (25,2% vs. 18,5%) und dass die Anwendung von PPI während der CDI-Behandlung mit einem um 42% erhöhten Rezidivrisiko verbunden war.12 Exponierte Patienten, die älter als 80 Jahre waren, hatten das höchste Risiko.12 Eine kürzlich durchgeführte Analyse von Daten aus Patientenentlassungen aus einem tertiären medizinischen Zentrum über einen Zeitraum von 5 Jahren ergab, dass das Risiko einer nosokomialen CDI positiv mit dem Grad der Säuresuppression korrelierte und bei Patienten, die mehr als einmal täglich eine PPI-Therapie erhielten, am höchsten war täglich, was auf einen Dosis-Wirkungs-Effekt auf das Risiko einer nosokomialen CDI hindeutet.13
Lungenentzündung: Obwohl die Untersuchungsergebnisse inkonsistent waren, haben mehrere Studien einen Zusammenhang zwischen der Verwendung von ASDs und einem erhöhten Risiko für Atemwegsinfektionen und CAP festgestellt. Eine kürzlich durchgeführte systematische Überprüfung und Meta-Analyse vorgeschlagen, dass die Verwendung von PPIs und H2As ist verbunden mit einem größeren Risiko für CAP und HAP, Schätzung eines Auftretens von einem Fall von Lungenentzündung für alle 200 stationären Patienten mit ASDs behandelt.20 In Anbetracht der Tatsache, dass 40% bis 70% der stationären Patienten ASDs erhalten, kann das Ausmaß der Morbidität und Mortalität von HAP voll und ganz geschätzt werden. Der größte Anstieg des mit PPIs verbundenen Lungenentzündungsrisikos wurde in der ersten Anwendungswoche beobachtet.20
Wie bei enterischen Infektionen wird angenommen, dass ASDs das Risiko einer Lungenentzündung erhöhen, indem sie die Sekretion von Magensäure hemmen und so ein bakterielles Überwachsen und Besiedeln ermöglichen. Bakterien können dann durch Aspiration in die Lunge transloziert werden.20 Bei mechanisch beatmeten Patienten kann eine oropharyngeale Kolonisation mit gramnegativen Organismen zu einer Magenkolonisation führen.19 Eine andere Theorie besagt, dass Wasserstoff-Kalium-Adenosintriphosphatase nicht nur in den Belegzellen des Magens, sondern auch in den Atemwegen vorhanden ist.20 Die Hemmung dieses Enzyms durch einen PPI könnte das Bakterienwachstum in den Atemwegen fördern und so zu einem erhöhten Lungenentzündungsrisiko führen.20 Schließlich haben In-vitro-Studien gezeigt, dass ASDs die Funktion von Neutrophilen und die Aktivität natürlicher Killerzellen beeinträchtigen können.20
Patienten über 65 Jahre haben ein erhöhtes Risiko für eine Lungenentzündung aufgrund von ASDs. Ältere Patienten sind nicht nur aufgrund des Alterungsprozesses im Allgemeinen Hypochlorit, sondern auch die Verwendung von PPI oder H2A ist in dieser Gruppe üblich; Bis zu 5% nehmen diese Medikamente regelmäßig ein, und ein hoher Prozentsatz älterer Krankenhauspatienten erhält SUP.21 Darüber hinaus sind viele PPI und H2A nicht verschreibungspflichtig, was zu einer verstärkten und nicht überwachten Anwendung führt, häufig über einen längeren Zeitraum ohne ärztliche Aufsicht.21
Sonstige Risiken: Neben CDI wurden auch andere enterische Infektionen — insbesondere durch Salmonellen— und Campylobacter-Arten – mit ASDs in Verbindung gebracht. Sowohl Campylobacter als auch Salmonellen sind säureempfindliche Mikroben. Parasitäre Infektionen wurden auch mit Säuresuppression in Verbindung gebracht, insbesondere Giardiasis und Strongyloidiasis.22 Wie bereits erwähnt, ist Magensäure wichtig für die Abtötung aufgenommener Organismen, aber ein erhöhter Magen-pH-Wert kann andere negative Auswirkungen auf die Abwehrkräfte des Magen-Darm-Wirts haben, wie z. B. verzögerte Magenentleerung, erhöhte bakterielle Translokation, verringerte Magen-Schleim-Viskosität und Veränderungen in der normalen mikrobiellen Flora.23
Arzneimittelwechselwirkungen sind ein weiteres Problem bei der Säuresuppression. Medikamente mit pH-abhängiger Absorption (d. H. Digoxin, Nifedipin, Indinavir, Midazolam, Didanosin, Alendronat, Methadon, Aspirin) können sowohl von PPIs als auch von H2AS beeinflusst werden, was zu erhöhten Absorptionsraten führt.9,24 Ebenso haben mehrere Arzneimittel die Resorptionsraten verringert (d. H. Ketoconazol, Cefpodoxim, Dipyridamol, Atazanavir, Itraconazol).24 Es gibt viele CYP450-bezogene Wechselwirkungen zwischen PPIs und anderen Arzneimitteln. Die mögliche Wechselwirkung zwischen PPI und Clopidogrel hat aufgrund möglicher schwerwiegender Nebenwirkungen Aufmerksamkeit erregt. Ein FDA-Sicherheitsalarm im November 2009 empfahl, die Verwendung von Omeprazol oder Esomeprazol mit Clopidogrel zu vermeiden, und warnte davor, dass die CYP-vermittelte Wechselwirkung die Wirksamkeit von Clopidogrel verringern könnte.22 Aufgrund unzureichender Daten gab die FDA keine spezifischen Empfehlungen zu anderen PPI ab.22
Es wurden mehrere Fälle von Patienten mit Hypomagnesiämie und nachfolgender Hypokaliämie und Hypokalzämie berichtet, bei denen lebensbedrohliche Symptome auftraten, die einen Krankenhausaufenthalt erforderten. Die meisten dieser Fälle waren mit einer langfristigen PPI-Anwendung verbunden. Der Mechanismus dieser nachteiligen Wirkung ist unbekannt. Bei Patienten mit PPI-induzierter Hypomagnesiämie ist keine offensichtliche Magnesiummalabsorption oder renale Magnesiumverschwendung aufgetreten.22 Obwohl Hypomagnesiämie selten ist, weil sie so lebensbedrohlich ist, sollten Anbieter bei PPI-Anwendern sorgfältig auf ungeklärte Hypomagnesiämie, Hypokaliämie oder Hypokalzämie achten.22
Die Anwendung von PPI über einen Zeitraum von 12 Monaten oder länger wurde insbesondere bei älteren Patienten mit einem Vitamin-B12-Mangel in Verbindung gebracht.9 Magensäure und Pepsin ermöglichen die Freisetzung von aufgenommenem Vitamin B12 aus seinem proteingebundenen Zustand; daher kann eine Verringerung der Magensäure zu Malabsorption und Vitamin B12-Mangel führen.22 Studienergebnisse waren inkonsistent, und es sind größere Studien erforderlich, um den Zusammenhang zwischen der Verwendung von PPI und der Malabsorption von Vitamin B12 und dem anschließenden Mangel zu definieren. Eine schlechte Absorption von Eisen aus der Nahrung wurde ebenfalls mit der PPI-Therapie in Verbindung gebracht, die aktuellen Daten sind jedoch schwach. Magensäure erleichtert die Absorption von Nichthäm-Eisen, indem sie Eisen (III) -Eisen auf die löslichere Eisenform reduziert und auch die Eisen-Salz-Dissoziation von aufgenommener Nahrung verbessert.22 Es gibt mehrere Fallberichte, aber es wurden keine prospektiven Studien in diesem Bereich durchgeführt.
Die Langzeitanwendung von PPI wurde mit einer erhöhten Inzidenz von Frakturen in Verbindung gebracht. Mögliche Mechanismen umfassen eine verminderte Absorption von Kalzium in einer alkalischeren Magenumgebung und eine Beeinträchtigung des Knochenumbaus aufgrund einer verminderten Osteoklastenaktivität, was zu einer gehemmten Reparatur von Mikrofrakturen führt.22 Auch hier sind die Studien inkonsistent, aber die vorhandenen Beweise reichten aus, um die FDA zu veranlassen, die PPI-Kennzeichnung im Mai 2010 zu überarbeiten, um neue Sicherheitsinformationen über das mögliche erhöhte Risiko von Frakturen der Hüfte, des Handgelenks und der Wirbelsäule aufzunehmen.22 Das Frakturrisiko kann bei Patienten mit Osteoporose oder anderen Risikofaktoren für Frakturen wie Steroidkonsum klinisch signifikanter sein. Ärzte werden ermutigt, die Risiken und Vorteile der PPI-Anwendung bei gefährdeten Patienten abzuwägen. Wenn Kalziumpräparate PPI-Anwendern verschrieben werden, sollten sie in einer löslichen Form wie Citrat und nicht in Carbonat vorliegen.22
Angemessene Verwendung
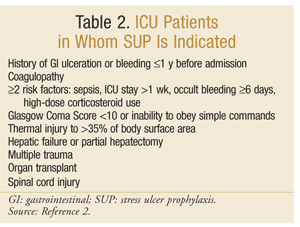
Die American Society of Health-System Pharmacists hat eine der umfassendsten evidenzbasierten Richtlinien für SUP entwickelt. Die aktuellen therapeutischen Leitlinien wurden 1999 veröffentlicht, wobei eine Aktualisierung in Bearbeitung ist.25 SUP wird nicht für Nicht-Intensivpatienten empfohlen; die Prophylaxe wird nur für Intensivpatienten empfohlen, die länger als 48 Stunden mechanisch beatmet werden müssen, innerhalb von 1 Jahr vor der Aufnahme eine Vorgeschichte von Magen-Darm-Geschwüren oder Blutungen haben oder an einer Koagulopathie leiden. Eine Prophylaxe wird auch für Intensivpatienten mit mindestens zwei der folgenden Risikofaktoren empfohlen: Sepsis, Intensivaufenthalt von mehr als 1 Woche, okkulte Blutungen von mindestens 6 Tagen und die Verwendung von hochdosierten Kortikosteroiden (Hydrocortison > 250 mg / Tag oder gleichwertig). Darüber hinaus wird SUP für spezielle Intensivpopulationen empfohlen, z. B. Patienten mit einem Glasgow Coma Score < 10 (oder Unfähigkeit, einfachen Befehlen zu gehorchen), thermische Verletzung von > 35% der Körperoberfläche, Leberversagen oder partielle Hepatektomie, multiples Trauma, Transplantationen oder Rückenmarksverletzung.2 Die Empfehlungen sind in TABELLE 2 zusammengefasst.
Schlussfolgerung: Rolle des Apothekers
Die Bemühungen von Klinikern, die Verwendung von ASDs bei Nicht-Intensivpatienten einzudämmen, können eine signifikante Morbidität der Patienten verhindern und sowohl die Krankenhauskosten als auch die Kosten für das gesamte Gesundheitssystem senken. Es ist wichtig, die Risiken und Vorteile von ASDs sorgfältig abzuwägen, bevor Sie diese Medikamente stationär einnehmen. Patienten, bei denen bereits ein Lungenentzündungsrisiko besteht, wie ältere Menschen, Patienten mit chronischer Lungenerkrankung und Patienten, die Immunsuppressiva einnehmen, sollten besonders berücksichtigt werden. Es sollten alle Anstrengungen unternommen werden, die Säuresuppressionstherapie bei stationären Patienten kritisch zu bewerten und die Therapie nach Möglichkeit abzubrechen. Wenn SUP angezeigt ist, sollte der Patient die niedrigstmögliche Dosis erhalten.
Apotheker können helfen, die Verwendung von ASDs einzudämmen, indem sie Patienten identifizieren, denen diese Medikamente unangemessen verschrieben werden, und sie können dazu beitragen, Ärzte darüber aufzuklären, welche Patienten SUP erhalten sollten. Apotheker, die an der Verarbeitung von Entlassungsmedikamenten beteiligt sind, können dazu beitragen, dass Patienten nicht ohne entsprechende Indikation mit einer säuresuppressiven Therapie nach Hause geschickt werden. Leider haben die Maßnahmen zur Vorbeugung von Stressgeschwüren bei Krankenhauspatienten ein neues Problem geschaffen, und durch die Zusammenarbeit kann das Gesundheitsteam dazu beitragen, weitere unnötige Morbidität zu verhindern, indem es Leitlinienempfehlungen in seiner Einrichtung durchsetzt.
1. In: Spirt MJ. Stressbedingte Schleimhauterkrankungen: Risikofaktoren und prophylaktische Therapie. Clin Ther. 2004;26:197-213.
2. ASHP therapeutische Richtlinien zur Stressulkus-Prophylaxe. ASHP Commission on Therapeutics und vom ASHP Board of Directors am 14.November 1998 genehmigt. In: J Health Syst Pharm. 1999;56:347-379.
3. Koch DJ, Griffith LE, Walter SD, et al. Die zurechenbare Mortalität und Dauer des Intensivaufenthalts klinisch wichtiger gastrointestinaler Blutungen bei kritisch kranken Patienten. Crit Pflege. 2001;5:368-375.
4. Koch DJ, Fuller HD, Guyatt GH, et al. Risikofaktoren für gastrointestinale Blutungen bei kritisch kranken Patienten. In: Canadian Critical Care Trials Group. In: N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. Therapeutische Ziele und Behandlungsmöglichkeiten zur Prävention des Stress-Ulkus-Syndroms. Bin J Med. 1987;83:29-35.
6. Harris SK, Knochen RC, Ruth WE. Gastrointestinale Blutung bei Patienten auf einer Atmungsintensivstation. Brust. 1977;72:301-304.
7. In: Sesler JM. Stressbedingte Schleimhauterkrankungen auf der Intensivstation: ein Update zur Prophylaxe. AACN Adv Crit Pflege. 2007;18:119-128.
8. Grube RR, Mai DB. Stressulkusprophylaxe bei Krankenhauspatienten nicht auf Intensivstationen. In: J Health Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Koomi JM. Übernutzung von Protonenpumpenhemmern: eine Überprüfung der Kostenwirksamkeit und des Risikos bei PPI. Bin J Gastroenterol. 2009;104(Ergänzung 2): S27-S32.
10. Heidelbaugh JJ, Kotomi JM. Ausmaß und wirtschaftliche Auswirkungen einer unangemessenen Anwendung der Stressulkusprophylaxe bei Nicht-Intensivpatienten im Krankenhaus. Bin J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. Warum verschreiben Ärzte allgemeinmedizinischen Patienten eine Stressulkusprophylaxe? Süd Med J. 2010;103: 1103-1110.
12. Linsky A., Gupta K., Lawler E.V., et al. Protonenpumpenhemmer und Risiko für rezidivierende Clostridium difficile-Infektion. In: Arch Intern Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Iatrogene Magensäuresuppression und das Risiko einer nosokomialen Clostridium difficile-Infektion. In: Arch Intern Med. 2010;170:784-790.
14. In: Kyne L, Hamel MB, Polavaram R, Kelly CP. Gesundheitskosten und Mortalität im Zusammenhang mit nosokomialem Durchfall aufgrund von Clostridum difficile. Clin Infizieren Dis. 2002;34:346-353.
15. Schröder MS. Clostridium difficile-assoziierte Diarrhoe. Am Fam Arzt. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: aktuelle epidemiologische Erkenntnisse und Fortschritte in der Therapie. Pharmakotherapie. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile Colitis. In: N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S.. Befeuert die übermäßige Verwendung von Protonenpumpenhemmern die aktuelle Epidemie von Clostridium difficile-assoziierter Diarrhö? J Hosp infizieren. 2008;70:1-6.
19. Vakil N. Säurehemmung und Infektionen außerhalb des Magen-Darm-Trakts. Bin J Gastroenterol. 2009;104:S17-S20.
20. In: Eom CS, Jeon CY, Lim JW, et al. Verwendung von Säuresuppressiva und Risiko einer Lungenentzündung: eine systematische Überprüfung und Metaanalyse. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Rezidivierende ambulant erworbene Pneumonie bei Patienten, die säurehemmende Medikamente einnehmen. Bin J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. Nachteilige Auswirkungen auf die Langzeittherapie mit Protonenpumpenhemmern. Dig Dis Sci. 2011;56:931-950.
23. Wählen Sie MS. Protonenpumpenhemmer und enterische Infektionen. Bin J Gastroenterol. 2009;104(Ergänzung 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Systematische Überprüfung: Beeinträchtigte Arzneimittelabsorption im Zusammenhang mit der gleichzeitigen Verabreichung einer antisekretorischen Therapie. In: Aliment Pharmacol Ther. 2009;29:1219-1229.
25. Amerikanische Gesellschaft der Apotheker des Gesundheitssystems. Therapeutisch guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx . Zugriff September 19, 2011.