Stresssårsprofylax: konsekvenserna av överanvändning och missbruk
US Pharm. 2011;36(10):73-76.
det verkar som om nästan varje patient som läggs in på sjukhuset i USA föreskrivs antingen en protonpumpshämmare (PPI) eller en histamin-2-antagonist (H2A) som stresssårsprofylax (SUP). Stresssår är gastriska mukosala erosioner som kan utvecklas hos patienter med allvarlig sjukdom eller allvarlig skada. Till skillnad från peptiska sår, som tenderar att utvecklas i antrum eller tolvfingertarmen, uppstår stressrelaterade slemhinneskador vanligtvis i de syraproducerande områdena i magen (dvs corpus och fundus).1 stresssår, till skillnad från peptiska sår, tenderar att orsaka gastrointestinal (GI) blödning och är inte förknippade med buksmärta. Mukosala förändringar av stressrelaterad mukosal skada involverar huvudsakligen små erosioner som inte leder till blödning men kan utvecklas till djupare sår, vilket orsakar blödning.
flera faktorer bidrar till bildandet av stresssår, inklusive syrahypersekretion; förändring av normala skyddsmekanismer såsom slem-och bikarbonatsekretioner; frisättning av mediatorer såsom arakidonsyrametaboliter, cytokiner och syrefria radikaler; och ischemi till GI-systemet.2 Dessa erosioner kan inträffa snabbt (24 timmar efter intag av 24 timmar) eller ta längre tid att utveckla (>10-14 dagar).2 stresssår och relaterad blödning orsakar betydande sjuklighet och dödlighet hos kritiskt sjuka patienter. En studie rapporterade en dödlighet på 46% hos kritiskt sjuka patienter med GI-blödning jämfört med 21% hos de utan blödning (P <.001).3 andra studier har bekräftat denna höga dödlighet.4,5
stora studier har visat att de starkaste riskfaktorerna för stressrelaterad GI-blödning är långvarig mekanisk ventilation och koagulopati.4 risken ökar med ökande antal dagar med mekanisk ventilation och längden på ICU-vistelsen.6 andra riskfaktorer inkluderar nyligen större operation, större trauma, svåra brännskador, huvudtrauma, lever-eller njursjukdom vid antagning, sepsis och hypotoni.1 Tabell 1 ger en fullständig lista över riskfaktorer.

profylaktisk terapi
även om det visat sig vara mycket effektivt för att minska risken för både öppen och kliniskt viktig stressrelaterad slemhinneblödning, minskar inte profylaktisk terapi ensam den totala dödligheten.7 ändå stöds förskrivningen av PPI eller H2A som SUP av litteraturen och av riktlinjer för den kritiska vårdpopulationen. Under de senaste åren har användningen av SUP hos icke-ICU—patienter—ofta utan indikation-ökat. Flera studier har visat överanvändning av syraundertryckande läkemedel (ASDs); så många som 71% av de antagna patienterna ordineras ASD, med många som felaktigt släpps ut med dessa medel.8 Många patienter ordineras felaktigt ASD i samhället, och lite görs för att avbryta dessa läkemedel under sjukhusvistelse. Dessutom patienter på två gånger dagligen PPI dosering för att behandla gastroesofageal refluxsjukdom (GERD) symtom ofta inte klev ner till en enda daglig dos terapi när de är asymtomatiska.9
överanvändning och missbruk av ASD kan leda till patientskador och ökade kostnader för sjukvården. Antalet som behövs för att behandla (NNT) för att förhindra en enda episod av kliniskt signifikant GI-blödning i ICU överstiger 900; NNT är okänt i icke-ICU-inställningen, men förväntas vara mycket högre.9 i en retrospektiv kohortstudie på ett akademiskt sjukhus var inpatientkostnader för SUP i icke-ICU-inställningen $44,000 årligen och polikliniska apotekskostnader var nästan $68,000 när drogerna fortsatte efterladdning, för en kombinerad årlig beräknad utgift på nästan $112,000.10 Detta kunde lätt ha förhindrats.
mot bakgrund av denna statistik är SUP fortfarande överskrivet. I en tvärsnitts webbaserad undersökning som bedömde läkarnas kunskaper, övertygelser och beteende angående förskrivning av SUP hos icke-ICU-patienter var rädsla för GI-blödning och de juridiska följderna av att inte förskriva SUP associerade med en högre förskrivningsnivå, medan kunskap om SUP-indikationer och oro för biverkningar var förknippade med lågt förskrivningsbeteende.11 Färre än hälften av läkarna kunde identifiera en enda biverkning av PPI-terapi.11 många utövare ser dessa läkemedel som ofarliga, men studier har föreslagit att PPI-och H2A-terapi är starkt förknippad med en större sannolikhet för Clostridium difficile-infektion (CDI) och ökade återfall.12,13 andra ofta förbisedda risker förknippade med denna terapi inkluderar hypomagnesemi; vitamin B12-brist; övre luftvägsinfektioner, inklusive samhällsförvärvad lunginflammation (CAP) och sjukhusförvärvad lunginflammation (HAP); frakturer i höft, ryggrad och handleder; och förändrad absorption av pH-beroende läkemedel.
risker för behandling
CDI: Toxinet som produceras av C difficile, en anaerob, sporbildande, gram-positiv bakterie, är en viktig orsak till diarre och kolit hos sjukhuspatienter som har ökat i incidens, svårighetsgrad och dödlighet de senaste åren. Cirka 3 miljoner fall inträffar årligen i USA och sjukvårdskostnaderna överstiger 1,1 miljarder dollar per år.14,15 C difficile–inducerad pseudomembranös kolit har en dödlighet på 6% till 30%.16 CDI har varit inblandad i 20% till 30% av alla fall av antibiotikaassocierad diarre, 50% till 75% av fallen av antibiotikaassocierad kolit och mer än 90% av fallen av antibiotikaassocierad pseudomembranös kolit hos sjukhuspatienter.17
trots bättre kontroll av förskrivning av antibiotika och förbättringar av sjukhushygien fortsätter antalet CDI-fall att öka.18 förbättrad diagnos, hypervirulenta stammar och en åldrande befolkning kan ha bidragit till detta, men dessa faktorer förklarar inte helt omfattningen av de senaste ökningarna.18 vanliga riskfaktorer för CDI inkluderar ålder över 65 år, nuvarande och återkommande sjukhusvistelse, nyligen GI-operation, immunsuppression, tidigare CDI, bosatt i vårdhem eller långtidsvård och antibiotikaanvändning. Antibiotikaanvändning är den största riskfaktorn för utveckling av CDI, men det kan ofta inte undvikas hos patienter med infektioner. En mindre vanlig men mer modifierbar riskfaktor är användningen av ASDs hos sjukhuspatienter i vilka dessa läkemedel inte är angivna.
magsyra är en icke-specifik skyddsmekanism mot intagna patogener. Magen är normalt fri från bakterier, med undantag av Helicobacter pylori, som är unikt utrustad för att hantera magsyra.19 C difficile överförs genom intag, och dess relativt syrastabila sporer fortsätter att gro i tunntarmen och tjocktarmen. De vegetativa cellerna i C difficile, till skillnad från sporerna, dödas vanligtvis i magsäckens låga pH-miljö; de har emellertid visat sig förbli livskraftiga i maginnehållet hos patienter som tar ASD. Forskning i djurmodeller har visat att C difficile-sporer förvandlas till vegetativa celler inom 1 timme efter intag. Det är troligt att denna omvandling kan inträffa i magen om pH är högre eller vid långsammare gastriska transiteringstider.
flera studier har funnit ett samband mellan PPI eller H2A användning och CDI. En nyligen retrospektiv kohortstudie visade att återkommande CDI var vanligare hos patienter som exponerades för PPI än hos oexponerade patienter (25,2% mot 18,5%) och att PPI-användning under CDI-behandling var associerad med en 42% ökad risk för återfall.12 exponerade patienter äldre än 80 år hade den högsta risken.12 en ny analys av data från patientutsläpp från ett tertiärt Medicinskt Centrum under en 5-årsperiod visade att risken för nosokomial CDI var positivt korrelerad med nivån av syraundertryckning och var högst hos patienter som fick PPI-behandling mer än en gång dagligen, vilket tyder på en dos-responseffekt på risken för nosokomial CDI.13
pneumoni: Även om resultaten av undersökningar har varit inkonsekventa har flera studier funnit en koppling mellan användning av ASD och en ökad risk för luftvägsinfektioner och CAP. En ny systematisk granskning och metaanalys föreslog att användningen av PPI och H2A är förknippad med en större risk för både CAP och HAP, vilket uppskattar en förekomst av ett fall av lunginflammation för varje 200 inpatienter som behandlas med ASD.20 Med tanke på att 40% till 70% av patienterna får ASD, kan storleken på sjukligheten och dödligheten hos HAP uppskattas fullt ut. Den största ökningen av risken för lunginflammation i samband med PPI observerades under den första veckan av användning.20
som med enteriska infektioner tros ASD öka risken för lunginflammation genom att hämma utsöndringen av magsyra, vilket möjliggör bakteriell överväxt och kolonisering. Bakterier kan sedan translokeras till lungorna genom aspiration.20 hos mekaniskt ventilerade patienter kan orofaryngeal kolonisering med gramnegativa organismer leda till gastrisk kolonisering.19 En annan teori är att vätekaliumadenosintrifosfatas är närvarande inte bara i parietalcellerna i magen utan också i luftvägarna.20 hämning av detta enzym med en PPI kan uppmuntra bakterietillväxt i luftvägarna, vilket leder till en ökad risk för lunginflammation.20 Slutligen har in vitro-studier visat att ASD kan försämra neutrofilernas funktion och aktiviteten hos naturliga mördarceller.20
patienter över 65 år har ökad risk för lunginflammation på grund av ASD. Inte bara är äldre patienter i allmänhet hypokloriska på grund av åldringsprocessen, men PPI-eller H2A-användning är vanligt i denna grupp; upp till 5% tar dessa mediciner regelbundet, och en hög andel äldre patienter på sjukhus får SUP.21 dessutom kräver många PPI och H2A inte recept, vilket resulterar i ökad och oövervakad användning, ofta under långa perioder utan medicinsk övervakning.21
andra risker: förutom CDI har andra enteriska infektioner—särskilt från Salmonella och Campylobacter—arter-associerats med ASDs. Både Campylobacter och Salmonella är syrakänsliga mikrober. Parasitiska infektioner har också kopplats till syraundertryckning, särskilt giardiasis och strongyloidiasis.22 som tidigare nämnts är magsyra viktig vid dödandet av intagna organismer, men ett förhöjt gastriskt pH kan ha andra negativa effekter på GI-värdförsvar, såsom försenad gastrisk tömning, ökad bakteriell translokation, minskad gastrisk slemviskositet och förändringar i den normala mikrobiella floran.23
läkemedelsinteraktioner är ett annat problem med syraundertryckning. Läkemedel med pH-beroende absorption (dvs digoxin, nifedipin, indinavir, midazolam, didanosin, alendronat, metadon, aspirin) kan påverkas av både PPI och H2A, vilket resulterar i ökade absorptionshastigheter.9,24 på samma sätt har flera läkemedel minskat absorptionshastigheter (dvs ketokonazol, cefpodoxim, dipyridamol, atazanavir, itrakonazol).24 Det finns många CYP450-relaterade interaktioner mellan PPI och andra läkemedel. Den potentiella interaktionen mellan PPI och klopidogrel har väckt uppmärksamhet på grund av eventuella allvarliga biverkningar. En FDA – säkerhetsvarning i November 2009 rekommenderade att man undviker användning av omeprazol eller esomeprazol med klopidogrel, varning för att den CYP-medierade interaktionen skulle kunna minska klopidogrels effektivitet.22 på grund av otillräckliga data gav FDA inga specifika rekommendationer om andra PPI.22
flera fall av patienter med hypomagnesemi och efterföljande hypokalemi och hypokalcemi som uppvisade livshotande symtom som kräver sjukhusvistelse har rapporterats. De flesta av dessa fall var förknippade med långvarig PPI-användning. Mekanismen för denna negativa effekt är okänd. Hos patienter med PPI-inducerad hypomagnesemi har ingen uppenbar magnesiummalabsorption eller renalt magnesiumavfall inträffat.22 även om hypomagnesemi är sällsynt, eftersom det är så livshotande leverantörer uppmuntras att titta noga på oförklarlig hypomagnesemi, hypokalemi eller hypokalcemi hos PPI-användare.22
användningen av PPI i 12 månader eller längre har associerats med vitamin B12-brist, särskilt hos äldre patienter.9 magsyra och pepsin möjliggör frisättning av intaget vitamin B12 från dess proteinbundna tillstånd; därför kan minskning av magsyra leda till malabsorption och vitamin B12-brist.22 studieresultat har varit inkonsekventa och större studier behövs för att definiera sambandet mellan PPI-användning och vitamin B12-malabsorption och efterföljande brist. Dålig absorption av dietjärn har också kopplats till PPI-terapi, men nuvarande data är svaga. Magsyra underlättar absorptionen av nonheme-järn genom att reducera järnjärn till den mer lösliga järnformen och förbättrar också järn-saltdissociation från intagen mat.22 flera fallrapporter finns, men inga prospektiva studier har utförts inom detta område.
långvarig PPI-användning har associerats med en ökad förekomst av frakturer. Möjliga mekanismer inkluderar minskad absorption av kalcium i en mer alkalisk gastrisk miljö och försämring av benremodellering på grund av minskad osteoklastaktivitet, vilket leder till inhiberad mikrofrakturreparation.22 återigen är studierna inkonsekventa, men befintliga bevis var tillräckliga för att få FDA att revidera PPI-märkningen i maj 2010 för att inkludera ny säkerhetsinformation om den möjliga ökade risken för frakturer i höft, handled och ryggrad.22 risken för fraktur kan vara mer kliniskt signifikant hos patienter med osteoporos eller andra riskfaktorer för fraktur, såsom steroidanvändning. Läkare uppmuntras att väga riskerna och fördelarna med PPI-användning hos utsatta patienter. Om kalciumtillskott ordineras till PPI-användare, bör de vara i löslig form, såsom citrat, snarare än karbonat.22
lämplig användning
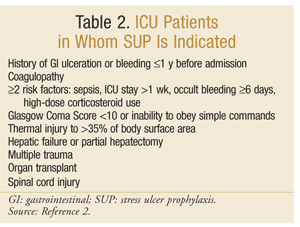
American Society of Health-System Pharmacists har utvecklat en av de mest omfattande evidensbaserade riktlinjerna för SUP. De nuvarande terapeutiska riktlinjerna publicerades 1999, med en uppdatering pågår vid detta skrivande.25 SUP rekommenderas inte för icke-ICU-patienter; profylax rekommenderas endast för ICU-patienter som behöver mekanisk ventilation i mer än 48 timmar, har en historia av GI-sår eller blödning inom 1 år före inträde eller som har koagulopati. Profylax rekommenderas också för ICU-patienter med minst två av följande riskfaktorer: sepsis, ICU-vistelse som överstiger 1 vecka, ockult blödning som varar 6 dagar eller mer och användning av högdos kortikosteroider (hydrokortison >250 mg/dag eller motsvarande). Dessutom rekommenderas SUP för speciella ICU-populationer, såsom patienter med en Glasgow Coma-poäng <10 (eller oförmåga att lyda enkla kommandon), termisk skada till >35% av kroppsytan, leversvikt eller partiell hepatektomi, multipel trauma, transplantationer eller ryggmärgsskada.2 rekommendationerna sammanfattas i tabell 2.
slutsats: apotekares Roll
insatser av kliniker för att begränsa användningen av ASD hos icke-ICU-patienter kan förhindra betydande patientmorbiditet och minska både sjukhuskostnader och kostnader för det övergripande hälsovårdssystemet. Det är viktigt att noga väga riskerna och fördelarna med ASDs innan du använder dessa läkemedel i slutenvården. Särskild hänsyn bör tas till patienter som redan riskerar lunginflammation, såsom äldre, de med kronisk lungsjukdom och de som tar immunsuppressiva medel. Alla ansträngningar bör göras för att kritiskt bedöma syraundertryckningsterapi hos inpatienter och att avbryta behandlingen när det är möjligt. När SUP indikeras ska patienten få lägsta möjliga dos.
apotekare kan hjälpa till att hejda användningen av ASD genom att identifiera patienter som är felaktigt föreskrivna dessa läkemedel, och de kan vara avgörande för att utbilda läkare om vilka patienter som ska få SUP. Apotekare som är involverade i behandling av urladdningsmedicin kan hjälpa till att säkerställa att patienter inte skickas hem på syraundertryckande terapi utan lämplig indikation. Tyvärr har de åtgärder som vidtagits för att förebygga stresssår hos sjukhuspatienter skapat ett nytt problem, och genom att arbeta tillsammans kan vårdteamet hjälpa till att förhindra ytterligare onödig sjuklighet genom att tillämpa riktlinjerekommendationer vid deras institution.
1. Spirt MJ. Stressrelaterad slemhinnesjukdom: riskfaktorer och profylaktisk terapi. Clin Ther. 2004;26:197-213.
2. ASHP terapeutiska riktlinjer för stresssårsprofylax. ASHP-kommissionen för terapi och godkänd av ASHP: s styrelse den 14 November 1998. Am J Hälsa Syst Pharm. 1999;56:347-379.
3. Han är en av de mest kända i världen. Den hänförliga dödligheten och längden på intensivvårdsavdelningens vistelse för kliniskt viktig gastrointestinal blödning hos kritiskt sjuka patienter. Crit Vård. 2001;5:368-375.
4. Han är en av de mest populära och mest populära. Riskfaktorer för gastrointestinal blödning hos kritiskt sjuka patienter. Kanadensiska Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. terapeutiska mål och behandlingsalternativ för förebyggande av stresssår syndrom. Am J Med. 1987;83:29-35.
6. Harris SK, Ben RC, Ruth vi. Gastrointestinal blödning hos patienter i en respiratorisk intensivvårdsavdelning. Kista. 1977;72:301-304.
7. Sesler JM. Stressrelaterad slemhinnesjukdom i intensivvården: en uppdatering om profylax. AACN Adv Crit Vård. 2007;18:119-128.
8. Grube RR, maj DB. Stresssårsprofylax hos sjukhuspatienter som inte finns på intensivvårdsavdelningar. Am J Hälsa Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Indomi JM. Överutnyttjande av protonpumpshämmare: en översyn av kostnadseffektivitet och risk i PPI. Am J Gastroenterol. 2009; 104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Omfattning och ekonomisk inverkan av olämplig användning av stresssårsprofylax hos icke-ICU-sjukhuspatienter. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain s, Stefan M, Visintainer P, Rothberg M. varför ordinerar läkare stresssårsprofylax till patienter med allmänmedicin? Söder Med J. 2010; 103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Protonpumpshämmare och risk för återkommande Clostridium difficile-infektion. Arch Praktikant Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Iatrogen magsyraundertryckning och risken för nosokomial Clostridium difficile-infektion. Arch Praktikant Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Sjukvårdskostnader och dödlighet i samband med nosokomial diarre på grund av Clostridum difficile. Clin Infektera Dis. 2002;34:346-353.
15. Schroeder MS Clostridium difficile-associerad diarre. Am Fam Läkare. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: senaste epidemiologiska fynd och framsteg inom terapi. Läkemedelsbehandling. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile kolit. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. är överanvändning av protonpumpshämmare som driver den nuvarande epidemin av Clostridium difficile-associerad diarre? J Hosp Infektera. 2008;70:1-6.
19. Vakil N. Syrainhibering och infektioner utanför mag-tarmkanalen. Am J Gastroenterol. 2009; 104: S17-S20.
20. EOM CS, Jeon CY, Lim JW, et al. Användning av syraundertryckande läkemedel och risk för lunginflammation: en systematisk granskning och metaanalys. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Återkommande samhällsförvärvad lunginflammation hos patienter som börjar syraundertryckande läkemedel. Am J Med. 2010;123:47-53.
22. Sheen e, Triadafilopoulos G. negativa effekter på långvarig protonpumpshämmare. Gräva Dis Sci. 2011;56:931-950.
23. Ring MS protonpumpshämmare användning och enteriska infektioner. Am J Gastroenterol. 2009; 104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, della Fave G. systematisk granskning: nedsatt läkemedelsabsorption relaterad till samtidig administrering av antisekretorisk terapi. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. American Society of Health-System Pharmacists. Terapeutiska guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. åtkomst 19 September 2011.