Forebyggelse af stresssår: konsekvenserne af overforbrug og misbrug
US Pharm. 2011;36(10):73-76.
det ser ud til, at næsten alle patienter, der er indlagt på hospitalet i USA, ordineres enten en protonpumpehæmmer (PPI) eller en histamin-2-antagonist (H2A) som stresssårsprofylakse (SUP). Stresssår er gastriske slimhindeerosioner, der kan udvikle sig hos patienter med alvorlig sygdom eller alvorlig skade. I modsætning til mavesår, der har tendens til at udvikle sig i antrum eller tolvfingertarm, forekommer stressrelaterede slimhindeskader typisk i de syrefremstillende områder i maven (dvs.corpus og fundus).1 stresssår, i modsætning til mavesår, har tendens til at forårsage gastrointestinal (GI) blødning og er ikke forbundet med mavesmerter. Slimhindeændringerne af stressrelateret slimhindeskade involverer hovedsageligt små erosioner, der ikke fører til blødning, men kan udvikle sig til dybere mavesår, der forårsager blødning.
flere faktorer bidrager til dannelse af stresssår, herunder syr hypersekretion; ændring af normale beskyttelsesmekanismer såsom slim og bicarbonatsekretioner; frigivelse af mediatorer såsom arachidonsyremetabolitter, cytokiner og iltfrie radikaler; og iskæmi til GI-systemet.2 Disse erosioner kan forekomme hurtigt (24 timers optagelse) eller tage længere tid at udvikle (>10-14 dage).2 stresssår og relateret blødning forårsager betydelig sygelighed og dødelighed hos kritisk syge patienter. En undersøgelse rapporterede en dødelighed på 46% hos kritisk syge patienter med GI-blødning sammenlignet med 21% hos dem uden blødning (P <.001).3 andre undersøgelser har bekræftet denne høje dødelighed.4,5
store undersøgelser har vist, at de stærkeste risikofaktorer for stressrelateret GI-blødning er langvarig mekanisk ventilation og koagulopati.4 risikoen stiger med stigende antal dage med mekanisk ventilation og længden af ICU-ophold.6 andre risikofaktorer inkluderer nylig større operation, større traumer, alvorlige forbrændinger, hovedtraume, lever-eller nyresygdom ved indlæggelse, sepsis og hypotension.1 tabel 1 indeholder en komplet liste over risikofaktorer.

profylaktisk terapi
selvom det har vist sig at være yderst effektivt til at reducere risikoen for både åbenlys og klinisk vigtig stressrelateret slimhindeblødning, reducerer profylaktisk terapi alene ikke den samlede dødelighed.7 alligevel understøttes ordination af PPI ‘er eller H2A’ er som SUP af litteraturen og af retningslinjer for den kritiske plejepopulation. I de senere år er brugen af SUP til ikke-ICU—patienter—ofte uden indikation-steget. Flere undersøgelser har vist overforbrug af syreundertrykkende lægemidler (ASDs); så mange som 71% af de indlagte patienter ordineres ASDs, hvor mange fejlagtigt udledes med disse midler.8 Mange patienter er uhensigtsmæssigt ordineret ASDs i samfundet, og der gøres lidt for at afbryde disse lægemidler under indlæggelse. Derudover patienter på PPI-dosering to gange dagligt til behandling af gastroøsofageal reflukssygdom (GERD) symptomer trækkes ofte ikke ned til behandling med en daglig dosis, når de er asymptomatiske.9
overforbrug og misbrug af ASDs kan resultere i patientskader og øgede omkostninger for sundhedssystemet. Antallet, der er nødvendigt for at behandle (NNT) for at forhindre en enkelt episode af klinisk signifikant GI-blødning i ICU, overstiger 900; NNT er ukendt I ikke-ICU-indstillingen, men forventes at være meget højere.9 i en retrospektiv kohortestudie på et akademisk hospital var indlæggelsesomkostninger for SUP I ikke-ICU-indstillingen $44.000 årligt, og ambulante apoteksomkostninger var næsten $68.000, da stofferne blev fortsat efter udledning, for en samlet årlig anslået udgift på næsten $112.000, 10 Dette kunne let have været forhindret.
i lyset af disse statistikker fortsætter SUP med at blive overbeskrevet. I en tværsnitsbaseret undersøgelse, der vurderer lægernes viden, overbevisninger og adfærd vedrørende ordination af SUP hos ikke-ICU-patienter, var frygt for GI-blødning og de juridiske konsekvenser af ikke at ordinere SUP forbundet med et højere ordineringsniveau, mens viden om SUP-indikationer og bekymring for bivirkninger var forbundet med lav ordineringsadfærd.11 færre end halvdelen af lægerne kunne identificere en enkelt bivirkning af PPI-behandling.11 mange praktiserende læger betragter disse lægemidler som ufarlige, men undersøgelser har antydet, at PPI-og H2A-terapi er stærkt forbundet med en større sandsynlighed for Clostridium difficile-infektion (CDI) og øgede tilbagefaldshastigheder.12,13 andre ofte oversete risici forbundet med denne terapi inkluderer hypomagnesæmi; vitamin B12-mangel; øvre luftvejsinfektioner, herunder samfundserhvervet lungebetændelse (CAP) og hospitalserhvervet lungebetændelse (HAP); brud på hofte, rygsøjle og håndled; og ændret absorption af pH-afhængige medicin.
risici ved terapi
CDI: Toksinet produceret af C difficile, en anaerob, sporeformende, gram-positiv bakterie, er en væsentlig årsag til diarre og colitis hos indlagte patienter, der er steget i forekomst, sværhedsgrad og dødelighed i de senere år. Cirka 3 Millioner tilfælde forekommer årligt i USA, og sundhedsomkostningerne overstiger 1,1 milliarder dollars om året.14,15 C difficile-induceret pseudomembranøs colitis har en dødelighed på 6% til 30%.16 CDI er blevet impliceret i 20% til 30% af alle tilfælde af antibiotikaassocieret diarre, 50% til 75% af tilfældene med antibiotikaassocieret colitis og mere end 90% af tilfældene med antibiotikaassocieret pseudomembranøs colitis hos indlagte patienter.17
på trods af bedre kontrol med antibiotisk ordination og forbedringer i hospitalshygiejnen fortsætter antallet af CDI-tilfælde med at stige.18 forbedret diagnose, hypervirulente stammer og en aldrende befolkning kan have bidraget til dette, men disse faktorer forklarer ikke fuldt ud omfanget af de seneste stigninger.18 almindelige risikofaktorer for CDI inkluderer alder over 65 år, nuværende og tilbagevendende indlæggelse, nylig GI-operation, immunsuppression, tidligere CDI, bosiddende på et plejehjem eller langtidsplejefacilitet og brug af antibiotika. Antibiotikabrug er den største risikofaktor for udvikling af CDI, men det kan ofte ikke undgås hos patienter med infektioner. En mindre almindelig, men mere modificerbar risikofaktor er brugen af ASDs hos indlagte patienter, hvor disse lægemidler ikke er indiceret.
mavesyre er en uspecifik beskyttelsesmekanisme mod indtagne patogener. Maven er normalt fri for bakterier, med undtagelse af Helicobacter pylori, som er unikt udstyret til at håndtere mavesyre.19 C difficile overføres ved indtagelse, og dens relativt syrestabile sporer fortsætter med at spire i tyndtarmen og tyktarmen. De vegetative celler af C difficile, i modsætning til sporerne, dræbes normalt i lav-pH-miljøet i maven; imidlertid har de vist sig at forblive levedygtige i maveindholdet hos patienter, der tager ASDs. Forskning i dyremodeller har vist, at C difficile sporer omdannes til vegetative celler inden for 1 time efter indtagelse. Det er sandsynligt, at denne transformation kan forekomme i maven, hvis pH er højere eller i tilfælde af langsommere gastrisk transittider.
flere undersøgelser har fundet en sammenhæng mellem PPI eller H2A brug og CDI. En nylig retrospektiv kohortestudie viste, at tilbagevendende CDI var mere almindelig hos patienter udsat for PPI ‘ er end hos ikke-eksponerede patienter (25,2% mod 18,5%), og at PPI-brug under CDI-behandling var forbundet med en 42% øget risiko for tilbagefald.12 eksponerede patienter i alderen over 80 år havde den højeste risiko.12 En nylig analyse af data fra patientudladninger fra et tertiært medicinsk center over en 5-årig periode viste, at risikoen for nosokomial CDI var positivt korreleret med niveauet af syreundertrykkelse og var højest hos patienter, der fik PPI-behandling mere end en gang dagligt, hvilket antyder en dosis-respons effekt på risikoen for nosokomial CDI.13
lungebetændelse: Selvom resultaterne af undersøgelser har været inkonsekvente, har flere undersøgelser fundet en sammenhæng mellem brugen af ASDs og en øget risiko for luftvejsinfektioner og CAP. En nylig systematisk gennemgang og metaanalyse antydede, at brugen af PPI ‘er og H2A’ er er forbundet med en større risiko for både CAP og HAP, estimering af en forekomst af et tilfælde af lungebetændelse for hver 200 indlagte patienter behandlet med ASDs.20 i betragtning af at 40% til 70% af de indlagte patienter modtager ASDs, kan størrelsen af sygeligheden og dødeligheden af HAP forstås fuldt ud. Den største stigning i risikoen for lungebetændelse forbundet med PPI ‘ er blev observeret i den første brugsuge.20
som med enteriske infektioner antages ASD ‘ er at øge risikoen for lungebetændelse ved at hæmme udskillelsen af mavesyre, hvilket tillader bakteriel overvækst og kolonisering. Bakterier kan derefter translokeres til lungerne ved aspiration.20 hos mekanisk ventilerede patienter kan oropharyngeal kolonisering med gramnegative organismer føre til gastrisk kolonisering.19 en anden teori er, at hydrogenkaliumadenosintriphosphatase ikke kun er til stede i parietalcellerne i maven, men også i luftvejene.20 hæmning af dette ved hjælp af en PPI kan tilskynde til bakterievækst i luftvejene, hvilket fører til en øget risiko for lungebetændelse.20 endelig har in vitro-undersøgelser vist, at ASDs kan forringe funktionen af neutrofiler og aktiviteten af naturlige dræberceller.20
patienter over 65 år har øget risiko for lungebetændelse på grund af ASDs. Ikke kun er ældre patienter generelt hypokloriske på grund af aldringsprocessen, men PPI-eller H2A-brug er almindelig i denne gruppe; op til 5% tager disse lægemidler regelmæssigt, og en høj procentdel af indlagte ældre patienter får SUP.21 derudover kræver mange PPI ‘er og H2A’ er ikke recept, hvilket resulterer i øget og uovervåget brug, ofte i lange perioder uden lægeligt tilsyn.21
andre risici: ud over CDI er andre enteriske infektioner—især fra Salmonella og Campylobacter—arter-blevet forbundet med ASDs. Både Campylobacter og Salmonella er syrefølsomme mikrober. Parasitære infektioner har også været forbundet med syreundertrykkelse, især giardiasis og strongyloidiasis.22 Som tidligere nævnt er mavesyre vigtig ved drab af indtagne organismer, men en forhøjet gastrisk pH kan have andre negative virkninger på GI-værtsforsvar, såsom forsinket gastrisk tømning, øget bakteriel translokation, nedsat gastrisk slimviskositet og ændringer i den normale mikrobielle flora.23
lægemiddelinteraktioner er et andet problem med syreundertrykkelse. Medicin med pH-afhængig absorption (dvs.digoksin, nifedipin, indinavir, didanosin, alendronat, metadon, aspirin) kan påvirkes af både PPI ‘er og H2A’ er, hvilket resulterer i øgede absorptionshastigheder.9,24 ligeledes har flere lægemidler nedsat absorptionshastighed (dvs.24 Der er mange CYP450-relaterede interaktioner mellem PPI ‘ er og andre lægemidler. Den potentielle interaktion mellem PPI ‘ er og clopidogrel har tiltrukket opmærksomhed på grund af mulige alvorlige bivirkninger. En FDA – sikkerhedsadvarsel i November 2009 anbefalede at undgå brug af clopidogrel og advarsel om, at den CYP-medierede interaktion kunne reducere clopidogrels effektivitet.22 på grund af utilstrækkelige data fremsatte FDA ingen specifikke anbefalinger vedrørende andre PPI ‘ er.22
flere tilfælde af patienter med hypomagnesæmi og efterfølgende hypokalæmi og hypokalcæmi, der præsenterede livstruende symptomer, der kræver indlæggelse, er rapporteret. De fleste af disse tilfælde var forbundet med langvarig PPI-brug. Mekanismen for denne negative virkning er ukendt. Hos patienter med PPI-induceret hypomagnesæmi er der ikke forekommet nogen tilsyneladende magnesiummalabsorption eller renal magnesiumudslip.22 selvom hypomagnesæmi er sjælden, fordi det er så livstruende udbydere opfordres til at holde øje med uforklarlig hypomagnesæmi, hypokalæmi eller hypokalcæmi hos PPI-brugere.22
brug af PPI ‘ er i 12 måneder eller længere har været forbundet med vitamin B12-mangel, især hos ældre patienter.9 mavesyre og pepsin muliggør frigivelse af indtaget vitamin B12 fra dets proteinbundne tilstand; derfor kan reduktion i mavesyre føre til malabsorption og vitamin B12-mangel.22 undersøgelsesresultater har været inkonsekvente, og større undersøgelser er nødvendige for at definere sammenhængen mellem PPI-brug og vitamin B12-malabsorption og efterfølgende mangel. Dårlig absorption af jern i kosten har også været forbundet med PPI-terapi, men de nuværende data er svage. Mavesyre letter absorptionen af nonheme jern ved at reducere jern til den mere opløselige jernform og forbedrer også jern-salt dissociation fra indtaget mad.22 Der findes flere sagsrapporter, men der er ikke udført nogen prospektive undersøgelser på dette område.
langvarig PPI-brug har været forbundet med en øget forekomst af brud. Mulige mekanismer inkluderer nedsat absorption af calcium i et mere alkalisk gastrisk miljø og svækkelse af knoglemodellering på grund af nedsat osteoklastaktivitet, hvilket fører til hæmmet mikrofrakturreparation.22 endnu en gang er undersøgelser inkonsekvente, men eksisterende beviser var nok til at bede FDA om at revidere PPI-mærkningen i maj 2010 for at inkludere nye sikkerhedsoplysninger om den mulige øgede risiko for brud på hofte, håndled og rygsøjle.22 risikoen for brud kan være mere klinisk signifikant hos patienter med osteoporose eller andre risikofaktorer for brud, såsom steroidbrug. Læger opfordres til at afveje risici og fordele ved PPI-brug hos sårbare patienter. Hvis calciumtilskud ordineres til PPI-brugere, skal de være i en opløselig form, såsom citrat, snarere end carbonat.22
passende brug
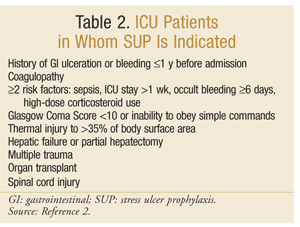
American Society of Health-System Pharmacists har udviklet en af de mest omfattende evidensbaserede retningslinjer for SUP. De nuværende terapeutiske retningslinjer blev offentliggjort i 1999 med en opdatering i gang ved denne skrivning.25 SUP anbefales ikke til ikke-ICU-patienter; profylakse anbefales kun til ICU-patienter, der har brug for mekanisk ventilation i mere end 48 timer, har en historie med GI-ulceration eller blødning inden for 1 år før optagelse, eller som har koagulopati. Profylakse anbefales også til ICU-patienter med mindst to af følgende risikofaktorer: sepsis, ICU-ophold over 1 uge, okkult blødning, der varer 6 dage eller mere, og brug af højdosis kortikosteroider (hydrocortison >250 mg/dag eller tilsvarende). Derudover anbefales SUP til specielle ICU-populationer, såsom patienter med en Coma score <10 (eller manglende evne til at adlyde enkle kommandoer), termisk skade på >35% af kropsoverfladearealet, leversvigt eller delvis hepatektomi, multiple traumer, transplantationer eller rygmarvsskade.2 anbefalingerne er sammenfattet i tabel 2.
konklusion: farmaceutens rolle
indsats fra klinikere for at begrænse brugen af ASDs hos ikke-ICU-patienter kan forhindre betydelig sygelighed hos patienter og reducere både hospitalsomkostninger og omkostninger til det samlede sundhedssystem. Det er vigtigt at omhyggeligt afveje risici og fordele ved ASDs, før du bruger disse lægemidler i indlæggelsesindstillingen. Der bør tages særlig hensyn til patienter, der allerede er i risiko for lungebetændelse, såsom ældre, patienter med kronisk lungesygdom og dem, der tager immunsuppressiva. Der bør gøres alt for kritisk at vurdere syreundertrykkelsesbehandling hos indlagte patienter og afbryde behandlingen, når det er muligt. Når SUP er indiceret, skal patienten have den lavest mulige dosis.
apotekere kan hjælpe med at stoppe brugen af ASDs ved at identificere patienter, der er uhensigtsmæssigt ordineret disse lægemidler, og de kan være medvirkende til at uddanne læger om, hvilke patienter der skal modtage SUP. Apotekere, der er involveret i behandling af udskrivningsmedicin, kan hjælpe med at sikre, at patienter ikke sendes hjem på syreundertrykkende terapi uden en passende indikation. Desværre har de foranstaltninger, der er truffet for at forhindre stresssår hos indlagte patienter, skabt et nyt problem, og ved at arbejde sammen kan sundhedsteamet hjælpe med at forhindre yderligere unødvendig sygelighed ved at håndhæve retningslinjeanbefalinger på deres institution.
1. Spirt MJ. Stressrelateret slimhindesygdom: risikofaktorer og profylaktisk terapi. Clin Ther. 2004;26:197-213.
2. ASHP terapeutiske retningslinjer for forebyggelse af stresssår. ASHP Commission on Therapeutics og godkendt af ASHP ‘ s bestyrelse den 14.November 1998. Am J Sundhed Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, han SD, et al. Den tilskrevne dødelighed og længden af intensivafdelingens ophold af klinisk vigtig gastrointestinal blødning hos kritisk syge patienter. Crit Care. 2001;5:368-375.
4. Kog DJ, fyldigere HD, Guyatt GH, et al. Risikofaktorer for gastrointestinal blødning hos kritisk syge patienter. Canadiske Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Terapeutiske mål og behandlingsmuligheder til forebyggelse af stress ulcus syndrom. Am J Med. 1987;83:29-35.
6. Harris SK, knogle RC, Ruth vi. Gastrointestinal blødning hos patienter i en respiratorisk intensivafdeling. Bryst. 1977;72:301-304.
7. Sesler JM. Stressrelateret slimhindesygdom i intensivafdelingen: en opdatering om profylakse. AACN Adv Crit pleje. 2007;18:119-128.
8. Grube RR, Maj DB. Forebyggelse af stresssår hos indlagte patienter ikke på intensivafdelinger. Am J Sundhed Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Overudnyttelse af protonpumpehæmmere: en gennemgang af omkostningseffektivitet og risiko i PPI. Er J Gastroenterol. 2009; 104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Omfang og økonomisk virkning af uhensigtsmæssig brug af stresssårsprofylakse hos ikke-ICU-indlagte patienter. Er J Gastroenterol. 2006;101:2200-2205.
11. Hussain s, Stefan M, Visintainer P, Rothberg M. hvorfor ordinerer læger forebyggelse af stresssår til patienter med generel medicin? Syd Med J. 2010;103:1103-1110.
12. Linsky A, Gupta K, lovgiver EV, et al. Protonpumpehæmmere og risiko for tilbagevendende Clostridium difficile infektion. Arch Praktikant Med. 2010;170:772-778.
13. MD, Novack V, Grgurich P, et al. Iatrogen gastrisk syreundertrykkelse og risikoen for nosokomial Clostridium difficile infektion. Arch Praktikant Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Sundhedsudgifter og dødelighed forbundet med nosokomial diarre på grund af Clostridum difficile. Clin Inficere Dis. 2002;34:346-353.
15. Schroeder MS. Clostridium difficile-associeret diarre. Am Fam Læge. 2005;71:921-928.
16. Nl, Musher DM. Clostridium difficile: nylige epidemiologiske fund og fremskridt inden for terapi. Farmakoterapi. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. er over-brug af protonpumpehæmmere brændstofpåfyldning den aktuelle epidemi af Clostridium difficile-associeret diarre? J Hosp Inficere. 2008;70:1-6.
19. Vakil N. Syreinhibering og infektioner uden for mave-tarmkanalen. Er J Gastroenterol. 2009; 104: S17-S20.
20. EOM CS, Jeon CY, Lim JV, et al. Anvendelse af syreundertrykkende lægemidler og risiko for lungebetændelse: en systematisk gennemgang og metaanalyse. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadovsky CA, Simpson SH, et al. Tilbagevendende samfundserhvervet lungebetændelse hos patienter, der starter syreundertrykkende lægemidler. Am J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. bivirkninger på langtidsbehandling med protonpumpehæmmere. Dig Dis Sci. 2011;56:931-950.
23. Dial Ms. protonpumpehæmmer brug og enteriske infektioner. Er J Gastroenterol. 2009; 104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. systematisk gennemgang: nedsat lægemiddelabsorption relateret til samtidig administration af antisekretorisk terapi. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. American Society of Health-System farmaceuter. Terapeutisk guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. adgang til 19. September 2011.