Stress Sår Profylakse: Konsekvensene av Overforbruk og Misbruk
US Pharm. 2011;36(10):73-76.
det virker som om nesten alle pasienter innlagt på sykehus i Usa er foreskrevet enten en protonpumpehemmer (ppi) eller en histamin-2 antagonist (H2A) som stress sår profylakse (SUP). Stress sår er mage mucosal erosjoner som kan utvikle seg hos pasienter med alvorlig sykdom eller alvorlig skade. I motsetning til magesår, som har en tendens til å utvikle seg i antrum eller tolvfingertarmen, oppstår stressrelaterte slimhinneskader vanligvis i de syreproduserende områdene i magen(dvs. corpus og fundus).1 Stresssår, i motsetning til magesår, har en tendens til å forårsake gastrointestinal (GI) blødning og er ikke forbundet med magesmerter. De mukosale endringene av stressrelatert slimhinneskade involverer hovedsakelig små erosjoner som ikke fører til blødning, men kan utvikle seg til dypere sår, noe som forårsaker blødning.
Flere faktorer bidrar til stress sårdannelse, inkludert syre hypersekresjon; endring av normale beskyttelsesmekanismer som slim og bikarbonatsekresjoner; frigjøring av mediatorer som arakidonsyremetabolitter, cytokiner og oksygenfrie radikaler; og iskemi til GI-systemet.2 disse erosjonene kan oppstå raskt (£24 timers opptak) eller ta lengre tid å utvikle (>10-14 dager).2 Stresssår og relatert blødning forårsaker signifikant sykelighet og dødelighet hos kritisk syke pasienter. En studie rapporterte en dødelighet på 46% hos kritisk syke PASIENTER med GI-blødning sammenlignet med 21% hos de uten blødning (P <.001).3 andre studier har bekreftet denne høye dødeligheten.4,5
Store studier har indikert at de sterkeste risikofaktorene for stressrelatert GI-blødning er langvarig mekanisk ventilasjon og koagulopati.4 risikoen øker med økende antall dager med mekanisk ventilasjon og LENGDEN PÅ ICU-oppholdet.6 andre risikofaktorer inkluderer nylig større kirurgi, større traumer, alvorlige forbrenninger, hodetrauma, lever-eller nyresykdom ved opptak, sepsis og hypotensjon.1 TABELL 1 gir en komplett liste over risikofaktorer.

Profylaktisk Behandling
selv om det har vist seg å være svært effektivt for å redusere risikoen for både åpen og klinisk viktig stressrelatert slimhinneblødning, reduserer profylaktisk behandling alene ikke den totale dødeligheten.7 forskrivning av Ppi eller H2a som SUP støttes Likevel Av litteraturen og av retningslinjer for kritisk omsorgspopulasjonen. De siste årene har BRUKEN AV SUP hos ikke-ICU—pasienter—ofte uten indikasjon-økt. Flere studier har vist overbruk av syre-undertrykkende stoffer (Asd); så mange som 71% av innlagte pasienter er foreskrevet Asd, med mange blir feilaktig utladet med disse midlene.8 Mange pasienter er feilaktig foreskrevet Asd i samfunnet, og lite er gjort for å avbryte disse medisinene under sykehusinnleggelse. I tillegg er pasienter på TO ganger DAGLIG ppi dosering for å behandle gastroøsofageal reflukssykdom (GERD) symptomer ofte ikke trappet ned til enkeltdosebehandling når de er asymptomatiske.9
overforbruk og misbruk av Asd kan føre til pasientskader og økte kostnader for helsevesenet. Antallet som trengs for å behandle (NNT) for å forhindre en enkelt episode av klinisk signifikant GI-blødning i ICU overstiger 900; NNT er ukjent i ikke-ICU-innstillingen, men forventes å være mye høyere.9 I en retrospektiv kohortstudie på et akademisk sykehus var pasientkostnader for SUP i ikke-ICU-innstillingen $44 000 årlig, og polikliniske apotekskostnader var nesten $68 000 da stoffene ble videreført etter utslipp, for en samlet årlig estimert utgift på nesten $112 000. 10 Dette kunne lett vært forhindret.
I lys av denne statistikken fortsetter SUP å bli overskrevet. I en tverrsnittsbasert nettbasert undersøkelse som vurderer legers kunnskap, tro og oppførsel angående forskrivning AV SUP hos ikke-ICU-pasienter, var frykt for GI-blødning og de juridiske konsekvensene av ikke å foreskrive SUP forbundet med et høyere forskrivningsnivå, mens kunnskap om SUP-indikasjoner og bekymring for bivirkninger var forbundet med lav forskrivningsadferd.11 Færre enn halvparten av legene kunne identifisere en enkelt bivirkning av ppi-behandling.11 mange utøvere ser på disse stoffene som ufarlige, men studier har antydet AT PPI-og H2A-terapi er sterkt forbundet med større sannsynlighet for Clostridium difficile-infeksjon (CDI) og økte tilbakefall.12,13 andre ofte oversett risiko forbundet med denne behandlingen inkluderer hypomagnesemi; vitamin B12-mangel; øvre luftveisinfeksjoner, inkludert lokalt oppkjøpt lungebetennelse (CAP) og sykehuskjøpt lungebetennelse( HAP); brudd i hofte, ryggrad og håndledd; og endret absorpsjon av pH-avhengige medisiner.
Risiko ved Behandling
CDI: Toksinet produsert Av c difficile, en anaerob, sporeformende, gram-positiv bakterie, er en viktig årsak til diare og kolitt hos pasienter med sykehus som har økt i forekomst, alvorlighetsgrad og dødelighet de siste årene. Omtrent 3 millioner tilfeller forekommer årlig i USA, og helsekostnadene overstiger $1,1 milliarder per år.14,15 c difficile–indusert pseudomembranøs kolitt har en dødelighet på 6% til 30%.16 CDI har vært involvert i 20% til 30% av alle tilfeller av antibiotikaassosiert diare, 50% til 75% av tilfellene av antibiotikaassosiert kolitt, og mer enn 90% av tilfellene av antibiotikaassosiert pseudomembranøs kolitt hos pasienter på sykehus.17
til tross for bedre kontroll av forskrivning av antibiotika og forbedringer i sykehushygiene, fortsetter ANTALL CDI-tilfeller å stige.18 Forbedret diagnose, hypervirulente stammer og en aldrende befolkning kan ha bidratt til dette, men disse faktorene forklarer ikke fullt ut omfanget av de siste økningene.18 Vanlige risikofaktorer for CDI inkluderer alder over 65 år, nåværende og tilbakevendende sykehusinnleggelse, nylig GI-kirurgi, immunosuppresjon, tidligere CDI, bosatt i sykehjem eller langtidspleie, og antibiotikabruk. Antibiotikabruk er den største risikofaktoren for UTVIKLING AV CDI, men det kan ofte ikke unngås hos pasienter med infeksjoner. En mindre vanlig, men mer modifiserbar risikofaktor er bruk Av Asd hos pasienter med sykehus der disse legemidlene ikke er indikert.
Magesyre er en uspesifikk beskyttelsesmekanisme mot inntatte patogener. Magen er normalt fri for bakterier, med unntak Av Helicobacter pylori, som er unikt utstyrt for å håndtere magesyre.19 c difficile overføres ved inntak, og dens relativt syrestabile sporer fortsetter å spire i tynntarmen og tykktarmen. De vegetative cellene I c difficile, i motsetning til sporer, blir vanligvis drept i lav-pH-miljøet i magen; de har imidlertid vist seg å forbli levedyktige i mageinnholdet hos pasienter som tar Asd. Forskning i dyremodeller har vist At c difficile sporer forvandles til vegetative celler innen 1 time etter inntak. Det er sannsynlig at denne transformasjonen kan oppstå i magen hvis pH er høyere eller ved langsommere gastrisk transittid.
Flere studier har funnet en sammenheng MELLOM PPI eller H2A bruk OG CDI. En nylig retrospektiv kohortstudie fant at tilbakevendende CDI var mer vanlig hos pasienter eksponert for Ppi enn hos ueksponerte pasienter (25,2% vs. 18,5%), og AT PPI-bruk under CDI-behandling var forbundet med en 42% økt risiko for tilbakefall.12 Eksponerte pasienter i alderen over 80 år hadde høyest risiko.12 en nylig analyse av data fra pasientutslipp fra et tertiært medisinsk senter over en 5-års periode fant at risikoen for nosokomial CDI var positivt korrelert med nivået av syreundertrykkelse og var høyest hos pasienter som fikk PPI-behandling mer enn en gang daglig, noe som tyder på en dose-respons effekt på risikoen for nosokomial CDI.13
Pneumoni: Selv om resultatene av undersøkelser har vært inkonsekvente, har flere studier funnet en sammenheng mellom Bruk Av Asd og økt risiko for luftveisinfeksjoner og CAP. En nylig systematisk gjennomgang og meta-analyse foreslo at bruk Av Ppi og H2As er forbundet med større risiko for BÅDE CAP og HAP, og estimerer en forekomst av ett tilfelle av lungebetennelse for hver 200 pasienter som behandles med Asd.20 Med Tanke på at 40% til 70% av pasientene får Asd, kan størrelsen på sykelighet og dødelighet AV HAP bli fullt verdsatt. Den største økningen i risikoen for lungebetennelse forbundet Med Ppi ble observert i den første uken av bruk.20
Som med enteriske infeksjoner, Antas Asd å øke risikoen for lungebetennelse ved å hemme sekresjonen av magesyre, og dermed tillate bakteriell overvekst og kolonisering. Bakterier kan da bli translokert til lungene ved aspirasjon.20 hos mekanisk ventilerte pasienter kan kolonisering av orofaryngeal med gram-negative organismer føre til kolonisering av magesekken.19 en annen teori er at hydrogenkaliumadenosintrifosfatase er tilstede ikke bare i parietalceller i magen, men også i luftveiene.20 Inhibering av dette enzymet MED EN PPI kan oppmuntre til bakteriell vekst i luftveiene, og dermed føre til økt risiko for lungebetennelse.20 Til slutt har in vitro-studier vist at Asd-Er kan svekke funksjonen til nøytrofiler og aktiviteten til naturlige dreperceller.20
Pasienter over 65 år har økt risiko for lungebetennelse på Grunn Av Asd. Ikke bare er eldre pasienter generelt hypoklor på grunn av aldringsprosessen, MEN PPI eller H2A bruk er vanlig i denne gruppen; opptil 5% tar disse medisinene regelmessig, og en høy andel av sykehus eldre pasienter får SUP.21 I Tillegg krever mange Ppi og H2a ikke resept, noe som resulterer i økt og uovervåket bruk, ofte i lange perioder uten medisinsk tilsyn.21
Andre Risikoer: i TILLEGG TIL CDI har andre enteriske infeksjoner—spesielt Fra Salmonella—og Campylobacter-arter-vært forbundet med Asd. Både Campylobacter og Salmonella er syrefølsomme mikrober. Parasittiske infeksjoner har også vært knyttet til syreundertrykkelse, spesielt giardiasis og strongyloidiasis.22 som tidligere nevnt er magesyre viktig ved drap av inntatte organismer, men en forhøyet gastrisk pH kan ha andre negative effekter på GI-vertsforsvar, for eksempel forsinket gastrisk tømming, økt bakteriell translokasjon, redusert gastrisk slimviskositet og endringer i den normale mikrobielle floraen.23
Legemiddelinteraksjoner er en annen bekymring med syreundertrykkelse. Legemidler med ph-avhengig absorpsjon (dvs. digoksin, nifedipin, indinavir, midazolam, didanosin, alendronat, metadon, aspirin) kan påvirkes av Både Ppi og H2As, noe som resulterer i økt absorpsjonshastighet.9,24 på samme måte har flere legemidler redusert absorpsjonshastigheter (dvs.ketokonazol, cefpodoxim, dipyridamol, atazanavir, itrakonazol).24 DET er MANGE cyp450-relaterte interaksjoner mellom Ppi og andre legemidler. Den potensielle interaksjonen Mellom Ppi og klopidogrel har vakt oppsikt på grunn av mulige alvorlige bivirkninger. ET FDA – sikkerhetsvarsel i November 2009 anbefalte å unngå bruk av omeprazol eller esomeprazol sammen med klopidogrel, og advarte om AT CYP-mediert interaksjon kunne redusere klopidogrels effektivitet.22 PÅ grunn av utilstrekkelige data gjorde FDA ingen spesifikke anbefalinger angående andre Ppi.22
Det er rapportert Flere tilfeller av pasienter med hypomagnesemi og påfølgende hypokalemi og hypokalsemi som hadde livstruende symptomer som krever sykehusinnleggelse. De fleste av disse tilfellene var forbundet med langvarig BRUK AV PPI. Mekanismen for denne negative effekten er ukjent. Hos pasienter med PPI-indusert hypomagnesemi har det ikke forekommet noen åpenbar magnesiummalabsorpsjon eller renal magnesiumavfall.22 selv om hypomagnesemi er sjelden, fordi det er så livstruende leverandører oppfordres til å se nøye på uforklarlig hypomagnesemi, hypokalemi eller hypokalsemi hos ppi-brukere.22
bruk Av Ppi i 12 måneder eller lenger har vært forbundet med vitamin B12-mangel, spesielt hos eldre pasienter.9 magesyre og pepsin muliggjør frigjøring av inntatt vitamin B12 fra sin proteinbundne tilstand; derfor kan reduksjon i magesyre føre til malabsorpsjon og vitamin B12-mangel.22 Studieresultater har vært inkonsekvente, og større studier er nødvendig for å definere sammenhengen MELLOM PPI-bruk og vitamin B12 malabsorpsjon og påfølgende mangel. Dårlig absorpsjon av jern i kosten har også vært knyttet TIL ppi-terapi, men dagens data er svake. Magesyre letter absorpsjonen av nonheme jern ved å redusere jern til den mer oppløselige jernformen, og forbedrer også jern-salt-dissosiasjon fra inntatt mat.Det finnes 22 flere kasusrapporter, men det er ikke utført prospektive studier på dette området.
Langvarig BRUK AV PPI har vært assosiert med økt forekomst av frakturer. Mulige mekanismer inkluderer redusert absorpsjon av kalsium i et mer alkalisk magemiljø og nedsatt benremodellering på grunn av redusert osteoklastaktivitet, noe som fører til hemmet mikrofrakturreparasjon.22 igjen er studier inkonsekvente, men eksisterende bevis var nok til å be FDA om å revidere ppi-merkingen I Mai 2010 for å inkludere ny sikkerhetsinformasjon om mulig økt risiko for brudd i hofte, håndledd og ryggrad.22 risikoen for brudd kan være mer klinisk signifikant hos pasienter med osteoporose eller andre risikofaktorer for brudd, som for eksempel steroidbruk. Leger oppfordres til å veie risiko og fordeler VED BRUK AV PPI hos sårbare pasienter. Hvis kalsiumtilskudd er foreskrevet TIL ppi-brukere, bør de være i en løselig form, for eksempel citrat, i stedet for karbonat.22
Hensiktsmessig Bruk
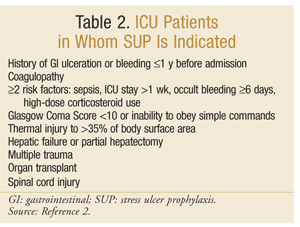
American Society Of Health-System Farmasøyter har utviklet en av De mest omfattende evidensbaserte retningslinjer FOR SUP. De nåværende terapeutiske retningslinjene ble publisert i 1999, med en oppdatering pågår ved denne skrivingen.25 SUP anbefales ikke for IKKE-ICU-pasienter; profylakse anbefales kun FOR ICU-pasienter som trenger mekanisk ventilasjon i mer enn 48 timer, har en HISTORIE med GI sårdannelse eller blødning innen 1 år før opptak, eller som har koagulopati. Profylakse anbefales også FOR INTENSIVPASIENTER med minst to av følgende risikofaktorer: sepsis, INTENSIVPASIENTER over 1 uke, okkult blødning som varer i 6 dager eller mer, og bruk av høydose kortikosteroider (hydrokortison >250 mg / dag eller tilsvarende). I TILLEGG anbefales SUP for SPESIELLE INTENSIVPOPULASJONER, for eksempel pasienter med Glasgow Coma Score <10 (eller manglende evne til å adlyde enkle kommandoer), termisk skade på >35% av kroppsoverflaten, leversvikt eller delvis hepatektomi, flere traumer, transplantasjoner eller ryggmargsskade.2 anbefalingene er oppsummert I TABELL 2.
Konklusjon: Apotekers Rolle
Klinikeres Innsats for å dempe bruken av Asd hos pasienter som ikke ER ICU, kan forhindre betydelig pasientmorbiditet og redusere både sykehuskostnader og kostnader til det generelle helsevesenet. Det er viktig å nøye veie risiko og fordeler av Asd før du bruker disse medikamentene i innleggelse. Spesielle hensyn bør tas til pasienter som allerede har risiko for lungebetennelse, som eldre, de med kronisk lungesykdom og de som tar immunsuppressive midler. Alle anstrengelser bør gjøres for å kritisk vurdere syreundertrykkende behandling hos pasienter og for å avbryte behandlingen når det er mulig. NÅR SUP er indisert, skal pasienten få lavest mulig dose.
Farmasøyter kan hjelpe demme bruken Av Asd ved å identifisere pasienter som er feilaktig foreskrevet disse medikamentene, og de kan være medvirkende i å utdanne leger om hvilke pasienter bør få SUP. Farmasøyter involvert i behandling av utslipp medisiner kan bidra til at pasientene ikke blir sendt hjem på syre-undertrykkende terapi uten en passende indikasjon. Dessverre har tiltakene som er tatt for å forebygge stresssår hos pasienter på sykehus, skapt et nytt problem, og ved å samarbeide kan helsevesenet bidra til å forhindre ytterligere unødvendig sykelighet ved å håndheve retningslinjeanbefalinger ved institusjonen.
1. Spir MJ. Stressrelatert mukosal sykdom: risikofaktorer og profylaktisk terapi. Clin Ther. 2004;26:197-213.
2. ASHP terapeutiske retningslinjer for stress sår profylakse. ASHP Commission On Therapeutics og godkjent av ASHP Styret 14. November 1998. Er J Helse Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, Walter SD, et al. Den henførbare dødeligheten og lengden på intensivavdelingens opphold av klinisk viktig gastrointestinal blødning hos kritisk syke pasienter. Crit Omsorg. 2001;5:368-375.
4. Cook DJ, Fuller HD, Guyatt GH, et al. Risikofaktorer for gastrointestinal blødning hos kritisk syke pasienter. Kanadiske Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. Terapeutiske mål Og behandlingsmuligheter for forebygging av stress sår syndrom. Am J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth VI. Gastrointestinal blødning hos pasienter i en respiratorisk intensivavdeling. Bryst. 1977;72:301-304.
7. Sesler JM. Stressrelatert mukosal sykdom i intensivavdelingen: en oppdatering på profylakse. Aacn Adv Crit Omsorg. 2007;18:119-128.
8. Grube RR, MAI DB. Stress sår profylakse hos innlagte pasienter ikke i intensivavdelinger. Er J Helse Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Overutilisering av protonpumpehemmere: en gjennomgang av kostnadseffektivitet og risiko VED PPI. Am J Gastroenterol. 2009; 104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Omfang og økonomiske konsekvenser av upassende bruk av stress sår profylakse i ikke-ICU innlagt pasienter. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. hvorfor foreskriver leger stress sår profylakse til generelle medisin pasienter? South Med J. 2010;103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Protonpumpehemmere og risiko for tilbakevendende Clostridium difficile infeksjon. Arch Intern Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Iatrogen magesyresuppresjon og risiko for Nosokomial Clostridium difficile-infeksjon. Arch Intern Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Helsekostnader og dødelighet forbundet med nosokomial diare på Grunn Av Clostridum difficile. Clin Infisere Dis. 2002;34:346-353.
15. Schroeder MS. Clostridium difficile-assosiert diare. Am Fam Lege. 2005;71:921-928.
16. McMaster-Baxter NL, Kjører DM. Clostridium difficile: nylige epidemiologiske funn og fremskritt i terapi. Farmakoterapi. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile kolitt. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. er overbruk av protonpumpehemmere drivstoff den nåværende epidemien Av Clostridium difficile-assosiert diare? J Hosp Infisere. 2008;70:1-6.
19. Vakil N. Syrehemming og infeksjoner utenfor mage-tarmkanalen. Am J Gastroenterol. 2009; 104: S17-S20.
20. Eom CS, Jeon CY, Lim JW, et al. Bruk av syrehemmende legemidler og risiko for lungebetennelse: en systematisk oversikt og meta-analyse. CMAJ. 2011;183:310-319.
21. Jørgensen DT, Jørgensen CA, jørgensen s, et al. Tilbakevendende smittsom lungebetennelse hos pasienter som starter syreundertrykkende legemidler. Am J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. Bivirkninger på langtidsbehandling med protonpumpehemmere. Dig Dis Sci. 2011;56:931-950.
23. Dial MS. Protonpumpehemmer bruk og enteriske infeksjoner. Am J Gastroenterol. 2009; 104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Systematisk oversikt: nedsatt legemiddelabsorpsjon relatert til samtidig administrering av antisekretorisk terapi. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. American Society Of Health-System Farmasøyter. Terapeutisk guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. Besøkt 19.September 2011.