Prophylaxie de l’ulcère de stress: Les conséquences de la Surutilisation et de l’abus
NOUS Pharm. 2011;36(10):73-76.
Il semble que presque tous les patients admis à l’hôpital aux États-Unis se voient prescrire un inhibiteur de la pompe à protons (IPP) ou un antagoniste de l’histamine-2 (H2A) comme prophylaxie de l’ulcère de stress (SUP). Les ulcères de stress sont des érosions de la muqueuse gastrique qui peuvent se développer chez les patients atteints d’une maladie grave ou d’une blessure grave. Contrairement aux ulcères peptiques, qui ont tendance à se développer dans l’antre ou le duodénum, les lésions muqueuses liées au stress se produisent généralement dans les zones productrices d’acide de l’estomac (c’est-à-dire le corps et le fond d’œil).1 Les ulcères de stress, contrairement aux ulcères peptiques, ont tendance à provoquer des saignements gastro-intestinaux (IG) et ne sont pas associés à des douleurs abdominales. Les modifications muqueuses des lésions muqueuses liées au stress impliquent principalement de petites érosions qui ne conduisent pas à des saignements, mais peuvent se transformer en ulcères plus profonds, qui provoquent des saignements.
Plusieurs facteurs contribuent à la formation d’ulcères de stress, y compris l’hypersécrétion acide; altération des mécanismes protecteurs normaux tels que les sécrétions de mucus et de bicarbonate; libération de médiateurs tels que les métabolites de l’acide arachidonique, les cytokines et les radicaux libres d’oxygène; et ischémie dans le système gastro-intestinal.2 Ces érosions peuvent se produire rapidement (£ 24 heures d’admission) ou prendre plus de temps à se développer (> 10-14 jours).2 Les ulcères de stress et les saignements associés provoquent une morbidité et une mortalité importantes chez les patients gravement malades. Une étude a rapporté un taux de mortalité de 46% chez les patients gravement malades présentant des saignements gastro-intestinaux contre 21% chez ceux sans saignement (P <.001).3 Autres études ont confirmé ce taux de mortalité élevé.4,5
De grandes études ont indiqué que les facteurs de risque les plus importants de saignement gastro-intestinal lié au stress sont la ventilation mécanique prolongée et la coagulopathie.4 Le risque augmente avec le nombre croissant de jours de ventilation mécanique et la durée du séjour aux soins intensifs.6 Les autres facteurs de risque comprennent une intervention chirurgicale majeure récente, un traumatisme majeur, des brûlures graves, un traumatisme crânien, une maladie hépatique ou rénale à l’admission, une septicémie et une hypotension.1 Le TABLEAU 1 fournit une liste complète des facteurs de risque.

Thérapie prophylactique
Bien qu’elle se soit avérée très efficace pour réduire le risque de saignements muqueux manifestes et cliniquement importants liés au stress, la thérapie prophylactique seule ne diminue pas le taux de mortalité global.7 Néanmoins, la prescription d’IPP ou d’A2 en tant que SUP est étayée par la littérature et par des lignes directrices à l’intention de la population en soins intensifs. Ces dernières années, l’utilisation de SUP chez les patients non en soins intensifs – souvent sans indication – a augmenté. Plusieurs études ont démontré la surutilisation de médicaments suppresseurs d’acides (TSA); jusqu’à 71% des patients admis se voient prescrire des TSA, beaucoup ayant reçu un congé par erreur avec ces agents.8 De nombreux patients se voient prescrire des TSA de manière inappropriée dans la communauté, et peu de choses sont faites pour arrêter ces médicaments pendant l’hospitalisation. De plus, les patients recevant une dose d’IPP deux fois par jour pour traiter les symptômes du reflux gastro-œsophagien (RGO) ne sont souvent pas soumis à un traitement à dose unique par jour une fois qu’ils sont asymptomatiques.9
La surutilisation et la mauvaise utilisation des TSA peuvent entraîner des préjudices pour les patients et une augmentation des coûts pour le système de soins de santé. Le nombre nécessaire pour traiter (NNT) pour prévenir un seul épisode de saignement gastro-intestinal cliniquement significatif en USI dépasse 900; le NNT est inconnu en dehors des soins intensifs, mais devrait être beaucoup plus élevé.9 Dans une étude de cohorte rétrospective dans un hôpital universitaire, les coûts d’hospitalisation pour le SUP en milieu non-USI étaient de 44 000 annually par année et les coûts de pharmacie ambulatoire étaient de près de 68 000 when lorsque les médicaments étaient maintenus après la décharge, pour une dépense annuelle estimée combinée de près de 112 0001.10 Cela aurait facilement pu être évité.
À la lumière de ces statistiques, le SUP continue d’être surprescrit. Dans une enquête transversale en ligne évaluant les connaissances, les croyances et le comportement des médecins concernant la prescription de SUP chez les patients non en soins intensifs, les craintes concernant les saignements gastro-intestinaux et les répercussions juridiques de la non-prescription de SUP étaient associées à un niveau de prescription plus élevé, tandis que la connaissance des indications de SUP et les préoccupations concernant les effets secondaires étaient associées à un faible comportement de prescription.11 Moins de la moitié des médecins ont pu identifier un seul effet secondaire du traitement par IPP.11 De nombreux praticiens considèrent ces médicaments comme inoffensifs, mais des études ont suggéré que le traitement par IPP et H2A est fortement associé à une plus grande probabilité d’infection à Clostridium difficile (ICD) et à des taux de récidive accrus.12,13 Les autres risques souvent négligés associés à ce traitement comprennent l’hypomagnésémie, la carence en vitamine B12, les infections des voies respiratoires supérieures, y compris la pneumonie acquise dans la communauté (PAC) et la pneumonie acquise à l’hôpital (HAP), les fractures de la hanche, de la colonne vertébrale et des poignets, et l’absorption altérée de médicaments dépendant du pH.
Risques du traitement
CDI: La toxine produite par le C difficile, une bactérie anaérobie à gram positif formant des spores, est une cause majeure de diarrhée et de colite chez les patients hospitalisés, dont l’incidence, la gravité et la mortalité ont augmenté ces dernières années. Environ 3 millions de cas surviennent chaque année aux États-Unis et les coûts des soins de santé dépassent 1,1 milliard de dollars par an.14,15 La colite pseudomembraneuse induite par le C difficile a un taux de mortalité de 6% à 30%.16 Le CDI a été impliqué dans 20% à 30% de tous les cas de diarrhée associée aux antibiotiques, 50% à 75% des cas de colite associée aux antibiotiques et plus de 90% des cas de colite pseudomembraneuse associée aux antibiotiques chez les patients hospitalisés.17
Malgré un meilleur contrôle de la prescription d’antibiotiques et des améliorations de l’hygiène hospitalière, le nombre de cas de CDI continue d’augmenter.18 L’amélioration du diagnostic, les souches hypervirulentes et le vieillissement de la population ont peut-être contribué à cela, mais ces facteurs n’expliquent pas entièrement l’ampleur des augmentations récentes.18 Les facteurs de risque courants d’ICD comprennent l’âge de plus de 65 ans, une hospitalisation actuelle et récurrente, une chirurgie gastro-intestinale récente, une immunosuppression, un CDI antérieur, une résidence dans une maison de retraite ou un établissement de soins de longue durée et l’utilisation d’antibiotiques. L’utilisation d’antibiotiques est le plus grand facteur de risque de développement de l’ICD, mais elle ne peut souvent pas être évitée chez les patients infectés. Un facteur de risque moins fréquent mais plus modifiable est l’utilisation de TSA chez les patients hospitalisés chez lesquels ces médicaments ne sont pas indiqués.
L’acide gastrique est un mécanisme de protection non spécifique contre les agents pathogènes ingérés. L’estomac est normalement exempt de bactéries, à l’exception de Helicobacter pylori, qui est spécialement équipé pour traiter l’acidité gastrique.19 Le C difficile se transmet par ingestion et ses spores relativement stables à l’acide germent dans l’intestin grêle et le côlon. Les cellules végétatives du C difficile, contrairement aux spores, sont généralement tuées dans l’environnement à faible pH de l’estomac; cependant, il s’est avéré qu’elles restent viables dans le contenu gastrique des patients prenant un TSA. La recherche sur des modèles animaux a montré que les spores de C difficile se transforment en cellules végétatives dans l’heure qui suit leur ingestion. Il est plausible que cette transformation puisse se produire dans l’estomac si le pH est plus élevé ou dans le cas de temps de transit gastrique plus lents.
Plusieurs études ont trouvé une association entre l’utilisation de l’IPP ou de l’H2A et l’IDC. Une étude de cohorte rétrospective récente a révélé que l’ICD récurrent était plus fréquent chez les patients exposés à des IPP que chez les patients non exposés (25,2% contre 18,5%) et que l’utilisation d’IPP pendant le traitement par l’ICD était associée à un risque accru de récidive de 42%.12 patients exposés âgés de plus de 80 ans présentaient le risque le plus élevé.12 Une analyse récente des données des sorties de patients d’un centre médical tertiaire sur une période de 5 ans a révélé que le risque d’ICD nosocomial était positivement corrélé au niveau de suppression acide et était le plus élevé chez les patients recevant un traitement par IPP plus d’une fois par jour, suggérant un effet dose-réponse sur le risque d’ICD nosocomial.13
Pneumonie: Bien que les résultats des études aient été incohérents, plusieurs études ont révélé une association entre l’utilisation des TSA et un risque accru d’infections des voies respiratoires et de PAC. Une revue systématique et une méta-analyse récentes ont suggéré que l’utilisation des IPP et des A2 est associée à un risque plus élevé de PAC et de PAH, estimant la survenue d’un cas de pneumonie pour 200 patients hospitalisés traités avec un TSA.20 Étant donné que 40% à 70% des patients hospitalisés reçoivent des TSA, l’ampleur de la morbidité et de la mortalité des HAP peut être pleinement appréciée. La plus forte augmentation du risque de pneumonie associée aux IPP a été observée au cours de la première semaine d’utilisation.20
Comme pour les infections entériques, on pense que les TSA augmentent le risque de pneumonie en inhibant la sécrétion d’acide gastrique, permettant ainsi la prolifération et la colonisation bactériennes. Les bactéries peuvent ensuite être transférées vers les poumons par aspiration.20 Chez les patients ventilés mécaniquement, la colonisation oropharyngée par des organismes à gram négatif peut entraîner une colonisation gastrique.19 Une autre théorie est que l’adénosine triphosphatase hydrogène-potassium est présente non seulement dans les cellules pariétales de l’estomac, mais également dans les voies respiratoires.20 L’inhibition de cette enzyme par un IPP pourrait favoriser la croissance bactérienne dans les voies respiratoires, entraînant ainsi un risque accru de pneumonie.20 Enfin, des études in vitro ont montré que les TSA peuvent altérer la fonction des neutrophiles et l’activité des cellules tueuses naturelles.20
Les patients de plus de 65 ans courent un risque accru de pneumonie due aux TSA. Non seulement les patients âgés sont généralement hypochloriques en raison du processus de vieillissement, mais l’utilisation de PPI ou de H2A est courante dans ce groupe; jusqu’à 5% prennent ces médicaments régulièrement et un pourcentage élevé de patients âgés hospitalisés reçoivent du SUP.21 De plus, de nombreux IPP et A2 ne nécessitent pas de prescription, ce qui entraîne une utilisation accrue et non surveillée, souvent pendant de longues périodes sans surveillance médicale.21
Autres risques: En plus de l’ICD, d’autres infections entériques — en particulier des espèces de Salmonella et de Campylobacter — ont été associées aux TSA. Campylobacter et Salmonella sont tous deux des microbes sensibles à l’acide. Les infections parasitaires ont également été liées à la suppression de l’acide, en particulier la giardiase et la strongyloïdose.22 Comme mentionné précédemment, l’acide gastrique est important dans la destruction des organismes ingérés, mais un pH gastrique élevé peut avoir d’autres effets négatifs sur les défenses de l’hôte gastro-intestinal, tels qu’une vidange gastrique retardée, une translocation bactérienne accrue, une diminution de la viscosité du mucus gastrique et des modifications de la flore microbienne normale.23
Les interactions médicamenteuses sont un autre problème de suppression des acides. Les médicaments dont l’absorption dépend du pH (c.-à-d. la digoxine, la nifédipine, l’indinavir, le midazolam, la didanosine, l’alendronate, la méthadone, l’aspirine) peuvent être affectés par les IPP et les A2, ce qui entraîne une augmentation des taux d’absorption.9,24 De même, plusieurs médicaments ont des taux d’absorption réduits (c.-à-d. le kétoconazole, le cefpodoxime, le dipyridamole, l’atazanavir, l’itraconazole).24 Il existe de nombreuses interactions liées au CYP450 entre les IPP et d’autres médicaments. L’interaction potentielle entre les IPP et le clopidogrel a attiré l’attention en raison d’effets indésirables graves possibles. Une alerte de sécurité de la FDA en novembre 2009 recommandait d’éviter l’utilisation de l’oméprazole ou de l’ésoméprazole avec le clopidogrel, avertissant que l’interaction médiée par le CYP pourrait réduire l’efficacité du clopidogrel.22 En raison de données insuffisantes, la FDA n’a formulé aucune recommandation spécifique concernant d’autres IPP.22
Plusieurs cas de patients présentant une hypomagnésémie et une hypokaliémie et une hypocalcémie subséquentes présentant des symptômes potentiellement mortels nécessitant une hospitalisation ont été rapportés. La plupart de ces cas étaient associés à une utilisation à long terme d’IPP. Le mécanisme de cet effet indésirable est inconnu. Chez les patients présentant une hypomagnésémie induite par l’IPP, aucune malabsorption apparente du magnésium ou émaciation rénale du magnésium n’a été observée.22 Bien que l’hypomagnésémie soit rare, parce qu’elle est si mortelle, les fournisseurs sont encouragés à surveiller attentivement l’hypomagnésémie, l’hypokaliémie ou l’hypocalcémie inexpliquées chez les utilisateurs d’IPP.22
L’utilisation d’IPP pendant 12 mois ou plus a été associée à une carence en vitamine B12, en particulier chez les patients âgés.9 L’acidité gastrique et la pepsine permettent la libération de la vitamine B12 ingérée à partir de son état lié aux protéines; par conséquent, la réduction de l’acide gastrique peut entraîner une malabsorption et une carence en vitamine B12.22 Les résultats de l’étude ont été incohérents et des études plus vastes sont nécessaires pour définir l’association entre l’utilisation de l’IPP et la malabsorption de la vitamine B12 et la carence subséquente. Une mauvaise absorption du fer alimentaire a également été liée au traitement par IPP, mais les données actuelles sont faibles. L’acide gastrique facilite l’absorption du fer non hème en réduisant le fer ferrique à la forme ferreuse plus soluble, et améliore également la dissociation fer-sel des aliments ingérés.22 Il existe plusieurs rapports de cas, mais aucune étude prospective n’a été réalisée dans ce domaine.
L’utilisation à long terme d’IPP a été associée à une incidence accrue de fractures. Les mécanismes possibles comprennent une diminution de l’absorption du calcium dans un environnement gastrique plus alcalin et une altération du remodelage osseux due à une diminution de l’activité des ostéoclastes, entraînant une réparation inhibée de la microfracture.22 Encore une fois, les études sont incohérentes, mais les preuves existantes étaient suffisantes pour inciter la FDA à réviser l’étiquetage des IPP en mai 2010 afin d’inclure de nouvelles informations de sécurité sur le risque accru possible de fractures de la hanche, du poignet et de la colonne vertébrale.22 Le risque de fracture peut être plus cliniquement significatif chez les patients atteints d’ostéoporose ou d’autres facteurs de risque de fracture, tels que l’utilisation de stéroïdes. Les médecins sont encouragés à évaluer les risques et les avantages de l’utilisation de l’IPP chez les patients vulnérables. Si des suppléments de calcium sont prescrits aux utilisateurs d’IPP, ils doivent être sous une forme soluble, telle que le citrate, plutôt que le carbonate.22
Utilisation appropriée
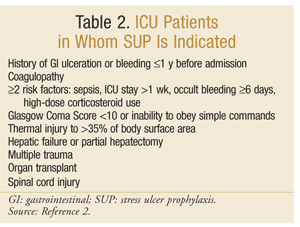
L’American Society of Health-System Pharmacists a élaboré l’une des lignes directrices les plus complètes fondées sur des données probantes pour le SUP. Les lignes directrices thérapeutiques actuelles ont été publiées en 1999, avec une mise à jour en cours à cette rédaction.25 SUP n’est pas recommandé pour les patients non en soins intensifs; la prophylaxie est recommandée uniquement pour les patients en soins intensifs qui ont besoin d’une ventilation mécanique pendant plus de 48 heures, qui ont des antécédents d’ulcération gastro-intestinale ou de saignement dans l’année précédant l’admission ou qui ont une coagulopathie. Une prophylaxie est également recommandée chez les patients en USI présentant au moins deux des facteurs de risque suivants: septicémie, séjour en USI supérieur à 1 semaine, saignement occulte d’une durée de 6 jours ou plus et utilisation de corticostéroïdes à forte dose (hydrocortisone > 250 mg / jour ou équivalent). De plus, le SUP est recommandé pour des populations spéciales de soins intensifs, telles que les patients présentant un score de Coma de Glasgow < 10 (ou une incapacité à obéir à des ordres simples), une lésion thermique à > 35% de la surface corporelle, une insuffisance hépatique ou une hépatectomie partielle, un traumatisme multiple, des greffes ou une lésion de la moelle épinière.2 Les recommandations sont résumées dans le TABLEAU 2.
Conclusion: Rôle du pharmacien
Les efforts des cliniciens pour limiter l’utilisation des TSA chez les patients non en soins intensifs peuvent prévenir une morbidité importante des patients et réduire à la fois les coûts hospitaliers et les coûts pour l’ensemble du système de soins de santé. Il est important de bien évaluer les risques et les avantages des TSA avant d’utiliser ces médicaments en milieu hospitalier. Une attention particulière doit être accordée aux patients déjà à risque de pneumonie, tels que les personnes âgées, celles atteintes d’une maladie pulmonaire chronique et celles prenant des immunosuppresseurs. Tous les efforts doivent être faits pour évaluer de manière critique le traitement par suppression de l’acide chez les patients hospitalisés et pour interrompre le traitement dans la mesure du possible. Lorsque SUP est indiqué, le patient doit recevoir la dose la plus faible possible.
Les pharmaciens peuvent aider à endiguer l’utilisation des TSA en identifiant les patients à qui ces médicaments sont prescrits de manière inappropriée, et ils peuvent contribuer à informer les médecins sur les patients qui devraient recevoir une PPA. Les pharmaciens impliqués dans le traitement des médicaments de sortie peuvent aider à s’assurer que les patients ne sont pas renvoyés chez eux sous traitement suppressif à l’acide sans indication appropriée. Malheureusement, les mesures prises pour prévenir les ulcères de stress chez les patients hospitalisés ont créé un nouveau problème et, en travaillant ensemble, l’équipe de soins de santé peut aider à prévenir d’autres morbidités inutiles en appliquant les recommandations des directives dans leur établissement.
1. Spirt MJ. Maladie muqueuse liée au stress: facteurs de risque et thérapie prophylactique. Clin Ther. 2004;26:197-213.
2. Directives thérapeutiques de l’ASHP sur la prophylaxie de l’ulcère de stress. Commission de l’ASHP sur les produits thérapeutiques et approuvé par le Conseil d’administration de l’ASHP le 14 novembre 1998. Am J Système de santé Pharm. 1999;56:347-379.
3. Il s’agit de l’un des plus grands groupes de la planète. La mortalité attribuable et la durée du séjour en unité de soins intensifs des saignements gastro-intestinaux cliniquement importants chez les patients gravement malades. Soins critiques. 2001;5:368-375.
4. Cook DJ, Fuller HD, Guyatt GH, et al. Facteurs de risque de saignement gastro-intestinal chez les patients gravement malades. Groupe Canadien des Essais en soins intensifs. En anglais J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. Objectifs thérapeutiques et options de traitement pour la prévention du syndrome de l’ulcère de stress. Am J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth NOUS. Hémorragie gastro-intestinale chez les patients dans une unité de soins intensifs respiratoires. Poitrine. 1977;72:301-304.
7. Sesler JM. Maladie des muqueuses liée au stress dans l’unité de soins intensifs: une mise à jour sur la prophylaxie. Soins critiques AACN Adv. 2007;18:119-128.
8. Grube RR, peut DB. Prophylaxie de l’ulcère de stress chez les patients hospitalisés non en unité de soins intensifs. Am J Système de santé Pharm. 2007;64:1396-1400.
9. Le juge Heidelbaugh, le juge Goldberg, le juge Inadomi. Surutilisation des inhibiteurs de la pompe à protons: examen de la rentabilité et des risques liés à l’IPP. Je suis Gastroentérol. 2009; 104 (complément 2): S27-S32.
10. Le juge Heidelbaugh, le juge Inadomi. Ampleur et impact économique de l’utilisation inappropriée de la prophylaxie de l’ulcère de stress chez les patients hospitalisés en soins non intensifs. Je suis Gastroentérol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. Pourquoi les médecins prescrivent-ils une prophylaxie de l’ulcère de stress aux patients en médecine générale? Med Sud J. 2010; 103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Inhibiteurs de la pompe à protons et risque d’infection récurrente à Clostridium difficile. Arch Intern Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et coll. Suppression de l’acide gastrique iatrogène et risque d’infection nosocomiale à Clostridium difficile. Arch Intern Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Coûts des soins de santé et mortalité associés à la diarrhée nosocomiale due à Clostridum difficile. Clin Infecte Dis. 2002;34:346-353.
15. Schroeder MS. Diarrhée associée à Clostridium difficile. Je suis Médecin de famille. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: découvertes épidémiologiques récentes et progrès thérapeutiques. Pharmacothérapie. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Colite à Clostridium difficile. En anglais J Med. 1994;330:257-262.
18. Cunningham R, Dial S. L’utilisation excessive d’inhibiteurs de la pompe à protons alimente-t-elle l’épidémie actuelle de diarrhée associée à Clostridium difficile? J Hosp Infecte. 2008;70:1-6.
19. Vakil N. Inhibition de l’acide et infections en dehors du tractus gastro-intestinal. Je suis Gastroentérol. 2009; 104: S17-S20.
20. Eom CS, Jeon CY, Lim JW et coll. Utilisation de médicaments suppresseurs d’acides et risque de pneumonie: revue systématique et méta-analyse. JAMC. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Pneumonie récurrente acquise dans la communauté chez les patients commençant des médicaments suppresseurs d’acide. Am J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. Effets indésirables sur la thérapie par inhibiteur de la pompe à protons à long terme. Dig Dis Sci. 2011;56:931-950.
23. Composez l’utilisation d’inhibiteurs de la pompe à protons et les infections entériques. Je suis Gastroentérol. 2009; 104 (complément 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Revue systématique: absorption altérée du médicament liée à la co-administration d’un traitement antisécrétoire. Alimentation Pharmacol Ther. 2009;29:1219-1229.
25. Société Américaine des Pharmaciens du Système de Santé. Thérapeutique guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx . Consulté le 19 septembre 2011.