A stresszfekély megelőzése: a túlzott használat és a visszaélés következményei
US Pharm. 2011;36(10):73-76.
úgy tűnik, mintha az Egyesült Államok kórházába felvett szinte minden betegnek protonpumpa-gátlót (PPI) vagy hisztamin-2 antagonistát (H2A) írnak fel stresszfekély profilaxisként (SUP). A stresszfekélyek olyan gyomornyálkahártya-eróziók, amelyek súlyos betegségben vagy súlyos sérülésben szenvedő betegeknél alakulhatnak ki. Ellentétben a peptikus fekélyekkel, amelyek általában az antrumban vagy a duodenumban alakulnak ki, a stressz okozta nyálkahártya-sérülések általában a gyomor savtermelő területein fordulnak elő (azaz a corpus és a fundus).1 A Stresszfekélyek, ellentétben a peptikus fekélyekkel, hajlamosak gastrointestinalis (GI) vérzést okozni, és nem járnak hasi fájdalommal. A stressz okozta nyálkahártya-sérülések nyálkahártya-változásai elsősorban kis eróziókkal járnak, amelyek nem vezetnek vérzéshez, de mélyebb fekélyekké alakulhatnak ki, amelyek vérzést okoznak.
számos tényező járul hozzá a stresszfekély kialakulásához, beleértve a savas hiperszekréciót; a normál védőmechanizmusok, például a nyálka és a bikarbonát váladék megváltoztatása; mediátorok, például arachidonsav metabolitok, citokinek és oxigén szabad gyökök felszabadulása; és ischaemia a GI rendszerbe.2 Ezek az eróziók gyorsan előfordulhatnak (a felvétel 24 órája), vagy hosszabb ideig tarthatnak (>10-14 nap).2 A Stresszfekélyek és a kapcsolódó vérzés jelentős morbiditást és mortalitást okoznak a kritikus állapotú betegeknél. Az egyik tanulmány 46% – os halálozási arányt jelentett a GI-vérzéssel küzdő kritikus betegeknél, szemben a vérzés nélküli betegek 21% – ával (P <.001).3 más tanulmányok megerősítették ezt a magas halálozási arányt.4,5
nagy vizsgálatok azt mutatták, hogy a stresszel összefüggő gastrointestinalis vérzés legerősebb kockázati tényezői a hosszan tartó mechanikus lélegeztetés és a coagulopathia.4 a kockázat növekszik a mechanikus szellőztetés napjainak és az ICU-tartózkodás hosszának növekedésével.6 egyéb kockázati tényezők közé tartozik a közelmúltban végzett nagy műtét, súlyos trauma, súlyos égési sérülések, fej trauma, máj-vagy vesebetegség a felvételkor, szepszisés hipotenzió.1 az 1. táblázat a kockázati tényezők teljes listáját tartalmazza.

profilaktikus terápia
bár bizonyítottan rendkívül hatékony mind a nyílt, mind a klinikailag fontos stressz okozta nyálkahártya-vérzés kockázatának csökkentésében, a profilaktikus terápia önmagában nem csökkenti az általános halálozási arányt.7 ennek ellenére a PPI-k vagy a H2A-k SUP-ként történő felírását az irodalom és a kritikus gondozásra vonatkozó irányelvek támasztják alá lakosság. Az elmúlt években a SUP alkalmazása nem intenzív osztályon szenvedő betegeknél-gyakran indikáció nélkül—nőtt. Több tanulmány kimutatta a savszuppresszív gyógyszerek (ASD)túlzott használatát; a befogadott betegek 71% – át írják fel ASD-kre, sokakat tévesen bocsátanak ki ezekkel a szerekkel.8 sok betegnek helytelenül írják fel az ASD-ket a közösségben, és keveset tesznek azért, hogy abbahagyják ezeket a gyógyszereket a kórházi kezelés alatt. Ezenkívül a betegek napi kétszeri PPI adagolással a gastrooesophagealis reflux betegség (GERD) tüneteinek kezelésére gyakran nem lépnek át napi egyszeri dózisú terápiára, ha tünetmentesek.9
az ASD-k túlzott használata és helytelen használata a betegek károsodásához és az egészségügyi rendszer költségeinek növekedéséhez vezethet. A kezeléshez szükséges szám (NNT) a klinikailag jelentős GI vérzés egyetlen epizódjának megelőzéséhez az ICU-ban meghaladja a 900-at; az NNT ismeretlen a nem ICU környezetben, de várhatóan sokkal magasabb lesz.9 egy akadémiai kórházban végzett retrospektív kohorsz vizsgálatban a SUP fekvőbeteg-költségei az ICU-n kívüli környezetben évente 44 000 dollár voltak, a járóbeteg-gyógyszertár költségei pedig közel 68 000 dollár voltak, amikor a gyógyszereket a mentesítés után folytatták, az éves becsült összköltség közel 112 000 dollár volt.10 ezt könnyen meg lehetett volna akadályozni.
e statisztikák fényében a SUP továbbra is túlértékelt. Egy keresztmetszeti webalapú felmérésben, amely az orvosok tudását, meggyőződését és viselkedését értékeli a SUP felírásával kapcsolatban nem ICU-s betegeknél, a GI vérzéstől való félelem és a SUP felírásának jogi következményei magasabb felírási szinttel társultak, míg a SUP indikációk ismerete és a mellékhatásokkal kapcsolatos aggodalom alacsony felírási magatartással társult.11 az orvosok kevesebb mint fele tudta azonosítani a PPI terápia egyetlen mellékhatását.11 sok orvos ezeket a gyógyszereket ártalmatlannak tartja, de a tanulmányok azt sugallják, hogy a PPI és a H2A terápia szorosan összefügg a Clostridium difficile fertőzés (CDI) nagyobb valószínűségével és a megnövekedett kiújulási arányokkal.12,13 a terápiával kapcsolatos egyéb gyakran figyelmen kívül hagyott kockázatok közé tartozik a hypomagnesemia; a B12-vitamin hiánya; felső légúti fertőzések, beleértve a közösségben szerzett tüdőgyulladást (CAP) és a kórházban szerzett tüdőgyulladást (hap); a csípő, a gerinc és a csukló törése; és a pH-függő gyógyszerek megváltozott felszívódása.
terápiás kockázatok
CDI: A toxin által termelt C difficile, anaerob, spóraképző, gram-pozitív baktérium, az egyik fő oka a hasmenés és a colitis kórházi betegeknél, hogy nőtt az előfordulási gyakorisága, súlyossága, és a halálozás az elmúlt években. Körülbelül 3 millió eset fordul elő évente az Egyesült Államokban, és az egészségügyi költségek meghaladják az évi 1,1 milliárd dollárt.A 14,15 C difficile által kiváltott pseudomembranosus colitis halálozási aránya 6-30%.16 a CDI az antibiotikumokkal összefüggő hasmenés összes esetének 20-30%-ában, az antibiotikumokkal összefüggő colitis esetek 50-75%-ában, az antibiotikumokkal összefüggő pseudomembranosus colitis esetek több mint 90%-ában érintett kórházi betegeknél.17
az antibiotikumok felírásának jobb ellenőrzése és a kórházi higiénia javítása ellenére a CDI-esetek száma továbbra is növekszik.18 A jobb diagnózis, a hipervirulens törzsek és az öregedő populáció hozzájárulhatott ehhez, de ezek a tényezők nem magyarázzák meg teljesen a közelmúltbeli növekedés mértékét.18 a CDI általános kockázati tényezői közé tartozik a 65 év feletti életkor, a jelenlegi és visszatérő kórházi kezelés, a közelmúltbeli GI műtét, immunszuppresszió, korábbi CDI, idősek otthonában vagy tartós gondozási intézményben való tartózkodás és antibiotikum-használat. Az antibiotikumok használata a CDI kialakulásának legnagyobb kockázati tényezője, de fertőzésben szenvedő betegeknél gyakran nem kerülhető el. Kevésbé gyakori, de módosítható kockázati tényező az ASD-k alkalmazása kórházi betegeknél, akiknél ezek a gyógyszerek nem javallottak.
a gyomorsav nem specifikus védőmechanizmus a lenyelt kórokozók ellen. A gyomor általában baktériumoktól mentes, kivéve a Helicobacter pylori – t, amely egyedülállóan fel van szerelve a gyomor savasságának kezelésére.19 A C difficile lenyelés útján terjed, és viszonylag saválló spórái tovább csíráznak a vékonybélben és a vastagbélben. A C difficile vegetatív sejtjei, a spórákkal ellentétben, általában a gyomor alacsony pH-jú környezetében pusztulnak el; kiderült azonban, hogy életképesek maradnak az ASD-t szedő betegek gyomortartalmában. Állatmodellekkel végzett kutatások kimutatták, hogy a C difficile spórák vegetatív sejtekké alakulnak a lenyeléstől számított 1 órán belül. Valószínű, hogy ez az átalakulás akkor fordulhat elő a gyomorban, ha a pH magasabb, vagy lassabb gyomor tranzitidő esetén.
számos tanulmány összefüggést talált a PPI vagy a H2A használat és a CDI között. Egy nemrégiben végzett retrospektív kohorsz vizsgálat megállapította, hogy a kiújuló CDI gyakoribb volt a PPI-knek kitett betegeknél, mint a megvilágítatlan betegeknél (25,2% vs.18,5%), és hogy a PPI alkalmazása a CDI-kezelés során 42% – kal nőtt a kiújulás kockázata.12 expozíciónak kitett, 80 évnél idősebb beteg volt a legnagyobb kockázattal.12 a tercier orvosi központból 5 év alatt történő betegkibocsátások adatainak nemrégiben végzett elemzése megállapította, hogy a nozokomiális CDI kockázata pozitívan korrelált a savszuppresszió szintjével, és a legmagasabb volt azoknál a betegeknél, akik naponta többször kaptak PPI-terápiát, ami dózis-válasz hatásra utal a nozokomiális CDI kockázatára.13
tüdőgyulladás: Bár a vizsgálatok eredményei ellentmondásosak voltak, számos tanulmány összefüggést talált az ASD-k alkalmazása és a légúti fertőzések és a CAP fokozott kockázata között. Egy nemrégiben végzett szisztematikus áttekintés és metaanalízis azt sugallta, hogy a PPI-k és a H2A-k használata mind a CAP, mind a HAP nagyobb kockázatával jár, becslve egy tüdőgyulladás előfordulását minden 200 ASD-vel kezelt fekvőbeteg esetében.20 tekintettel arra, hogy a fekvőbetegek 40-70% – a kap ASD-t, a HAP morbiditásának és mortalitásának nagysága teljes mértékben értékelhető. A PPI-kkel összefüggő tüdőgyulladás kockázatának legnagyobb növekedését a használat első hetében figyelték meg.20
az enterális fertőzésekhez hasonlóan úgy gondolják, hogy az ASD-k növelik a tüdőgyulladás kockázatát azáltal, hogy gátolják a gyomorsav szekrécióját, ezáltal lehetővé téve a baktériumok túlnövekedését és kolonizációját. A baktériumokat ezután aspirációval át lehet helyezni a tüdőbe.20 mechanikusan szellőztetett betegeknél az oropharyngealis kolonizáció gram-negatív organizmusokkal gyomor kolonizációhoz vezethet.19 Egy másik elmélet szerint a hidrogén-kálium-adenozin-trifoszfatáz nemcsak a gyomor parietális sejtjeiben, hanem a légzőrendszerben is jelen van.20 ennek az enzimnek a PPI általi gátlása ösztönözheti a baktériumok szaporodását a légutakban, ezáltal a tüdőgyulladás fokozott kockázatához vezethet.20 végül in vitro vizsgálatok kimutatták, hogy az ASD-k károsíthatják a neutrofilek működését és a természetes gyilkos sejtek aktivitását.20
a 65 évesnél idősebb betegeknél fokozott a tüdőgyulladás kockázata az ASD-k miatt. Nem csak az idős betegek általában hipoklórosak az öregedési folyamat miatt, de a PPI vagy a H2A használata gyakori ebben a csoportban; legfeljebb 5% szedi ezeket a gyógyszereket rendszeresen, és a kórházi idős betegek nagy százaléka kap SUP-t.21 ezenkívül számos PPI és H2A nem igényel receptet, ami fokozott és felügyelet nélküli használatot eredményez, gyakran hosszú ideig orvosi felügyelet nélkül.21
egyéb kockázatok: a CDI mellett más enterális fertőzések—különösen a Salmonella és a Campylobacter Fajok—társultak az ASD-kkel. Mind a Campylobacter, mind a Salmonella savérzékeny mikrobák. A parazita fertőzéseket a savszuppresszióval is összefüggésbe hozták, különösen a giardiasis és a strongyloidiasis.22 mint korábban említettük, a gyomorsav fontos szerepet játszik a lenyelt organizmusok elpusztításában, de a megnövekedett gyomor pH más negatív hatással lehet A GI gazdaszervezet védekezőképességére, mint például a késleltetett gyomorürítés, a baktériumok fokozott transzlokációja, a gyomor-nyálka viszkozitásának csökkenése, valamint a normál mikrobiális flóra változásai.23
a gyógyszerkölcsönhatások egy másik aggodalomra adnak okot a savszuppresszióval kapcsolatban. A pH-függő felszívódású gyógyszereket (azaz digoxint, Nifedipint, indinavirt, midazolámot, didanozint, alendronátot, metadont, aszpirint) mind a PPI-k, mind a H2A-k befolyásolhatják, ami fokozott felszívódási sebességet eredményez.9,24 hasonlóképpen, számos gyógyszer csökkent felszívódási sebességgel rendelkezik (azaz ketokonazol, cefpodoxim, dipiridamol, atazanavir, itrakonazol).24 a PPI-k és más gyógyszerek között számos CYP450-rel összefüggő kölcsönhatás van. A PPI-k és a klopidogrél közötti lehetséges kölcsönhatás a lehetséges súlyos mellékhatások miatt felkeltette a figyelmet. Az FDA 2009. novemberi biztonsági figyelmeztetése azt javasolta, hogy kerüljék az omeprazol vagy az ezomeprazol klopidogréllel történő alkalmazását, figyelmeztetve arra, hogy a CYP által közvetített kölcsönhatás csökkentheti a klopidogrél hatékonyságát.22 Az adatok elégtelensége miatt az FDA nem tett konkrét ajánlásokat más PPI-kre vonatkozóan.22
számos olyan hypomagnesaemiás és ezt követő hypokalaemiás és hypocalcaemiás betegről számoltak be, akiknél életveszélyes, kórházi kezelést igénylő tünetek jelentkeztek. Ezen esetek többsége hosszú távú PPI-használathoz kapcsolódott. Ennek a káros hatásnak a mechanizmusa nem ismert. PPI által kiváltott hypomagnesaemiában szenvedő betegeknél nem fordult elő nyilvánvaló magnézium felszívódási zavar vagy vese magnézium pazarlás.22 bár a hypomagnesemia ritka, mert annyira életveszélyes a szolgáltatókat arra ösztönzik, hogy gondosan figyeljék a megmagyarázhatatlan hypomagnesemia, hypokalemia vagy hypocalcaemia PPI-felhasználóknál.22
a PPI-k 12 hónapos vagy annál hosszabb ideig történő alkalmazása B12-vitaminhiányhoz társult, különösen idős betegeknél.9 a gyomor savassága és a pepszin lehetővé teszi a bevitt B12-vitamin felszabadulását fehérjéhez kötött állapotából; ezért a gyomorsav csökkenése felszívódási zavarhoz és B12-vitaminhiányhoz vezethet.22 a vizsgálati eredmények ellentmondásosak voltak, és nagyobb vizsgálatokra van szükség a PPI-használat és a B12-vitamin felszívódási zavar és az azt követő hiány közötti összefüggés meghatározásához. Az étrendi vas rossz felszívódása szintén összefügg a PPI terápiával, de a jelenlegi adatok gyengék. A gyomorsav megkönnyíti a nonheme vas felszívódását azáltal, hogy a vas vasat oldhatóbb vas formává redukálja, valamint fokozza a vas-só disszociációját az elfogyasztott ételektől.22 számos esettanulmány létezik, de ezen a területen nem végeztek prospektív vizsgálatokat.
a PPI hosszú távú alkalmazása a törések gyakoribb előfordulásával járt. A lehetséges mechanizmusok közé tartozik a kalcium csökkent felszívódása lúgosabb gyomorkörnyezetben, valamint a csontok átalakulásának károsodása a csökkent osteoclast aktivitás miatt, ami gátolt mikrotörés-javításhoz vezet.22 a vizsgálatok ismét ellentmondásosak, de a meglévő bizonyítékok elegendőek voltak ahhoz, hogy az FDA 2010 májusában felülvizsgálja a PPI címkézést, hogy új biztonsági információkat tartalmazzon a csípő -, csukló-és gerinctörések lehetséges fokozott kockázatáról.22 a törés kockázata klinikailag szignifikánsabb lehet osteoporosisban vagy a törés egyéb kockázati tényezőiben, például szteroidhasználatban szenvedő betegeknél. Az orvosokat arra ösztönzik, hogy mérlegeljék a PPI használatának kockázatait és előnyeit kiszolgáltatott betegeknél. Ha kalcium-kiegészítőket írnak fel a PPI-felhasználók számára, akkor oldható formában, például citrátban kell lenniük, nem pedig karbonátban.22
megfelelő használat
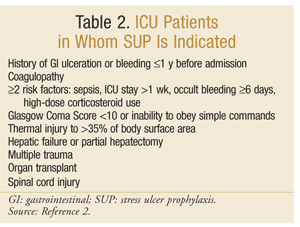
Az Amerikai Egészségügyi Rendszer gyógyszerészeinek Társasága kidolgozta az egyik legátfogóbb bizonyítékokon alapuló iránymutatást a SUP számára. A jelenlegi terápiás irányelveket 1999-ben tették közzé, ennek az írásnak a frissítése folyamatban van.25 a SUP nem ajánlott az ICU-n kívüli betegek számára; a profilaxis csak azoknak az ICU-betegeknek ajánlott, akiknek több mint 48 órán át mechanikus szellőztetést igényelnek, kórtörténetében GI fekély vagy vérzés szerepel a felvétel előtt 1 éven belül, vagy akiknek koagulopátiájuk van. A profilaxis az alábbi kockázati tényezők közül legalább kettővel rendelkező ICU-betegek számára is javasolt: szepszis, az ICU 1 hetet meghaladó tartózkodása, 6 vagy több napig tartó okkult vérzés, valamint nagy dózisú kortikoszteroidok alkalmazása (hidrokortizon >250 mg/nap vagy azzal egyenértékű). Ezenkívül a SUP ajánlott speciális ICU populációkhoz, például Glasgow kóma pontszámmal rendelkező betegekhez <10 (vagy képtelen betartani az egyszerű parancsokat), termikus sérülés a testfelület >35% – ára, májelégtelenség vagy részleges hepatectomia, többszörös trauma, transzplantáció vagy gerincvelő sérülés.2 az ajánlásokat a 2. táblázat foglalja össze.
következtetés: a gyógyszerész szerepe
a klinikusok erőfeszítései az ASD-k nem ICU-s betegeknél történő alkalmazásának megfékezésére megelőzhetik a betegek jelentős morbiditását és csökkenthetik mind a kórházi költségeket, mind a költségeket az általános egészségügyi rendszer. Fontos, hogy gondosan mérlegeljük az ASD-k kockázatait és előnyeit, mielőtt ezeket a gyógyszereket fekvőbeteg-környezetben használnánk. Különös figyelmet kell fordítani a tüdőgyulladás kockázatának már kitett betegekre, például az idősekre, a krónikus tüdőbetegségben szenvedőkre és az immunszuppresszánsokat szedőkre. Minden erőfeszítést meg kell tenni a fekvőbetegek savszuppressziós terápiájának kritikus értékelésére és a kezelés lehetőség szerinti abbahagyására. Ha a SUP javallt, a betegnek a lehető legalacsonyabb adagot kell kapnia.
a gyógyszerészek segíthetnek az ASD-k használatának megakadályozásában azáltal, hogy azonosítják azokat a betegeket, akiknek ezeket a gyógyszereket nem megfelelően írják fel, és fontos szerepet játszhatnak az orvosok oktatásában arról, hogy mely betegeknek kell SUP-t kapniuk. A kisülési gyógyszerek feldolgozásában részt vevő gyógyszerészek segíthetnek abban, hogy a betegeket megfelelő indikáció nélkül ne küldjék haza savszuppresszív terápiára. Sajnos a kórházi betegek stresszfekélyeinek megelőzésére tett intézkedések új problémát hoztak létre, és az egészségügyi csoport együttműködésével segíthet megelőzni a további felesleges morbiditást azáltal, hogy érvényesíti az irányelveket ajánlások intézményükben.
1. Spirt MJ. Stresszel összefüggő nyálkahártya-betegség: kockázati tényezők és profilaktikus terápia. Clin Ther. 2004;26:197-213.
2. ASHP terápiás irányelvek a stresszfekély megelőzésére. ASHP Bizottság Therapeutics és jóváhagyta az ASHP igazgatótanácsa November 14, 1998. Am J Egészségügyi Rendszer Pharm. 1999;56:347-379.
3. Szakács DJ, Griffith LE, Walter SD, és mtsai. A klinikailag jelentős gastrointestinalis vérzés tulajdonítható mortalitása és az intenzív osztályon való tartózkodás időtartama kritikus betegeknél. Crit Ellátás. 2001;5:368-375.
4. Szakács DJ, Fuller HD, Guyatt GH, et al. A gyomor-bélrendszeri vérzés kockázati tényezői kritikus betegeknél. Kanadai Kritikus Gondozási Próbacsoport. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. terápiás célok és kezelési lehetőségek a stresszfekély szindróma megelőzésére. Am J Med. 1987;83:29-35.
6. Harris SK, csont RC, Ruth mi. Gyomor-bélrendszeri vérzés betegeknél a légzési intenzív osztályon. Mellkas. 1977;72:301-304.
7. Sesler JM. Stressz okozta nyálkahártya-betegség az intenzív osztályon: egy frissítést a profilaxis. AACN Adv Crit Care. 2007;18:119-128.
8. Grube RR, lehet DB. A stressz fekély profilaxis, a kórházban ápolt betegek nem intenzív osztályon. Am J Egészségügyi Rendszer Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, Inadomi JM. Overutilization a protonpumpa-gátlók: felülvizsgálatát, költség-hatékonyság, valamint a kockázatok a PPI. Am J Gastroenterol. 2009;104(suppl 2):S27-S32.
10. Heidelbaugh JJ, Inadomi JM. A stresszfekély nem megfelelő alkalmazásának nagysága és gazdasági hatása profilaxis nem ICU kórházi betegeknél. Am J Gastroenterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. miért írják fel az orvosok a stresszfekély megelőzését az Általános Orvostudományi betegek számára? Dél Med J. 2010;103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV és mtsai. Protonpumpa-gátlók és a visszatérő Clostridium difficile fertőzés kockázata. Arch Gyakornok Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Iatrogén gyomorsav-szuppresszió és a nosocomialis Clostridium difficile fertőzés kockázata. Arch Gyakornok Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. A Clostridum difficile okozta nozokomiális hasmenéshez kapcsolódó egészségügyi költségek és halálozás. Clin Megfertőzi Dis-T. 2002;34:346-353.
15. Schroeder MS. Clostridium difficile okozta hasmenés. Fam Orvos Vagyok. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: a legújabb epidemiológiai eredmények és a terápia előrehaladása. Gyógyszeres kezelés. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. a protonpumpa-gátlók túlzott használata táplálja a Clostridium difficile okozta hasmenés jelenlegi járványát? J Hosp Megfertőzni. 2008;70:1-6.
19. Vakil N. savgátlás és fertőzések a gyomor-bél traktuson kívül. Am J Gastroenterol. 2009;104:S17-S20.
20. Eom CS, Jeon CY, Lim JW és mtsai. Savszuppresszív gyógyszerek alkalmazása és a tüdőgyulladás kockázata: szisztematikus áttekintés és metaanalízis. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Visszatérő közösség által szerzett tüdőgyulladás savcsökkentő gyógyszereket kezdő betegeknél. Am J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. káros hatások a hosszú távú protonpumpa-gátló terápiára. Dig Dis Sci. 2011;56:931-950.
23. Tárcsázza ms. protonpumpa inhibitor használatát és enterális fertőzéseket. Am J Gastroenterol. 2009;104(2. Kiegészítő): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Szisztematikus áttekintés: az antiszekréciós terápia együttes alkalmazásával kapcsolatos csökkent gyógyszerfelszívódás. Aliment Pharmacol Ther. 2009;29:1219-1229.
25. Amerikai Egészségügyi Rendszer gyógyszerészek Társasága. Terápiás guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. hozzáférés szeptember 19, 2011.