Stress ulcus profylaxe: de gevolgen van overmatig gebruik en misbruik
wij Pharm. 2011;36(10):73-76.
het lijkt erop dat bijna elke patiënt die in het ziekenhuis in de Verenigde Staten wordt opgenomen, een protonpompremmer (PPI) of een histamine-2-antagonist (H2A) als stress ulcus profylaxe (SUP) wordt voorgeschreven. Stresszweren zijn erosies van het maagslijmvlies die zich kunnen ontwikkelen bij patiënten met een ernstige ziekte of ernstig letsel. In tegenstelling tot maagzweren, die de neiging hebben zich te ontwikkelen in het antrum of de twaalfvingerige darm, komen stress-gerelateerde mucosale letsels meestal voor in de zuurproducerende gebieden van de maag (d.w.z., corpus en fundus).1 stresszweren, in tegenstelling tot maagzweren, hebben de neiging om gastro-intestinale (GI) bloedingen te veroorzaken en worden niet geassocieerd met buikpijn. De mucosale veranderingen van stress-gerelateerde mucosale schade voornamelijk gepaard gaan met kleine erosies die niet leiden tot bloedingen, maar kunnen zich ontwikkelen tot diepere zweren, die bloeden veroorzaken.
verschillende factoren dragen bij tot de vorming van ulcus bij stress, waaronder hypersecretie met zuur; wijziging van normale beschermende mechanismen zoals slijm-en bicarbonaatsecreties; afgifte van mediatoren zoals arachidonzuurmetabolieten, cytokines en zuurstof vrije radicalen; en ischemie aan het GI-systeem.2 Deze erosies kunnen snel optreden (£24 uur opname) of langer duren om zich te ontwikkelen (>10-14 dagen).2 stresszweren en gerelateerde bloedingen veroorzaken significante morbiditeit en mortaliteit bij ernstig zieke patiënten. Eén studie meldde een sterftecijfer van 46% bij ernstig zieke patiënten met gastro-intestinale bloedingen, vergeleken met 21% bij patiënten zonder bloeding (P <.001).3 andere studies hebben dit hoge sterftecijfer bevestigd.4,5
grote studies hebben aangetoond dat de sterkste risicofactoren voor stressgerelateerde GI-bloedingen langdurige mechanische beademing en coagulopathie zijn.4 het risico neemt toe met het toenemende aantal dagen mechanische ventilatie en de duur van de IC-verblijf.6 andere risicofactoren omvatten recente grote chirurgie, groot trauma, ernstige brandwonden, hoofdtrauma, lever-of nierziekte bij opname, sepsis, en hypotensie.1 Tabel 1 geeft een volledige lijst van risicofactoren.

profylactische therapie
hoewel bewezen is dat deze zeer effectief is bij het verminderen van het risico op zowel openlijke als klinisch belangrijke stressgerelateerde mucosale bloedingen, vermindert profylactische therapie alleen niet het totale sterftecijfer.7 toch wordt het voorschrijven van PPI ‘ s of H2As als SUP ondersteund door de literatuur en door richtlijnen voor de kritieke zorgpopulatie. In de afgelopen jaren is het gebruik van SUP bij niet-IC—patiënten—vaak zonder indicatie-toegenomen. Meerdere studies hebben het overmatig gebruik van zuur-onderdrukkende geneesmiddelen (ASDs)aangetoond; maar liefst 71% van de opgenomen patiënten krijgt ASDs voorgeschreven, waarvan velen ten onrechte met deze middelen worden ontslagen.8 veel patiënten worden ten onrechte voorgeschreven ASDs in de Gemeenschap, en weinig wordt gedaan om deze medicijnen te stoppen tijdens ziekenhuisopname. Bovendien, patiënten op tweemaal daagse ppi dosering voor de behandeling van gastro-oesofageale reflux ziekte (GERD) symptomen vaak niet verlaagd tot single-daily-dosis therapie zodra ze asymptomatisch.9
overmatig gebruik en misbruik van ASDs kan leiden tot schade voor de patiënt en hogere kosten voor de gezondheidszorg. Het aantal dat nodig is om te behandelen (NNT) om een enkele episode van klinisch significante GI-bloedingen op de IC te voorkomen, bedraagt meer dan 900; de NNT is onbekend in de niet-IC-setting, maar zal naar verwachting veel hoger zijn.9 In een retrospectieve cohortstudie in een academisch ziekenhuis bedroegen de intramurale kosten voor SUP in de niet-ICU-setting $ 44.000 per jaar en de kosten voor ambulante farmacie bijna $68.000 wanneer de geneesmiddelen na de aflossing werden voortgezet, voor een gecombineerde jaarlijkse geraamde uitgaven van bijna $112.000.10 dit had gemakkelijk kunnen worden voorkomen.
in het licht van deze statistieken wordt de SUP nog steeds overschreven. In een cross-sectional web-based survey waarin de kennis, overtuigingen en het gedrag van artsen met betrekking tot het voorschrijven van SUP bij niet-IC-patiënten werden beoordeeld, werden angsten over gastro-intestinale bloedingen en de juridische gevolgen van het niet voorschrijven van SUP geassocieerd met een hoger voorschrijfniveau, terwijl kennis van SUP-indicaties en bezorgdheid over bijwerkingen werden geassocieerd met laag voorschrijfgedrag.Minder dan de helft van de artsen kon één enkele bijwerking van PPI-therapie identificeren.11 veel beoefenaars zien deze geneesmiddelen als onschadelijk, maar studies hebben gesuggereerd dat PPI en H2A therapie is sterk geassocieerd met een grotere kans op Clostridium difficile infectie (CDI) en verhoogde recidief tarieven.12,13 andere vaak over het hoofd gezien risico ‘ s geassocieerd met deze therapie zijn hypomagnesiëmie; vitamine B12 deficiëntie; bovenste luchtweginfecties, met inbegrip van gemeenschap-verworven pneumonie (CAP) en ziekenhuis-verworven pneumonie (HAP); fracturen van de heup, wervelkolom en polsen; en veranderde absorptie van pH-afhankelijke medicijnen.
risico ‘ s van therapie
CDI: De toxine geproduceerd door C difficile, een anaërobe, spore-vormende, gram-positieve bacterie, is een belangrijke oorzaak van diarree en colitis in gehospitaliseerde patiënten die in incidentie, ernst en mortaliteit in de afgelopen jaren is toegenomen. Ongeveer 3 miljoen gevallen komen jaarlijks voor in de VS, en de kosten van de gezondheidszorg overschrijden $ 1,1 miljard per jaar.14,15 C difficile-geïnduceerde pseudomembraneuze colitis heeft een sterftecijfer van 6% tot 30%.16 CDI is betrokken bij 20% tot 30% van alle gevallen van met antibiotica geassocieerde diarree, 50% tot 75% van de gevallen van met antibiotica geassocieerde colitis, en meer dan 90% van de gevallen van met antibiotica geassocieerde pseudomembraneuze colitis bij gehospitaliseerde patiënten.17
ondanks een betere controle van het voorschrijven van antibiotica en verbeteringen in de ziekenhuishygiëne, blijft het aantal CDI-gevallen stijgen.18 verbeterde diagnose, hypervirulente stammen, en een verouderende bevolking kan hebben bijgedragen aan dit, maar deze factoren niet volledig verklaren de omvang van de recente stijgingen.18 gemeenschappelijke risicofactoren voor CDI omvatten leeftijd boven 65 jaar, huidige en terugkerende ziekenhuisopname, recente GI chirurgie, immunosuppressie, vorige CDI, woonachtig in een verpleeghuis of langdurige zorg faciliteit, en antibioticum gebruik. Het gebruik van antibiotica is de grootste risicofactor voor de ontwikkeling van CDI, maar het kan vaak niet worden vermeden bij patiënten met infecties. Een minder voorkomende maar meer aanpasbare risicofactor is het gebruik van ASDs in gehospitaliseerde patiënten bij wie deze geneesmiddelen niet zijn geïndiceerd.Maagzuur is een niet-specifiek beschermend mechanisme tegen ingenomen pathogenen. De maag is normaal gesproken vrij van bacteriën, met uitzondering van Helicobacter pylori, die uniek is uitgerust om maagzuur te behandelen.19 C difficile wordt overgedragen door inname, en de relatief zuur-stabiele sporen gaan kiemen in de dunne darm en dikke darm. De vegetatieve cellen van C difficile, in tegenstelling tot de sporen, worden meestal gedood in de lage pH-omgeving van de maag; echter, ze zijn gevonden om levensvatbaar te blijven in de maaginhoud van patiënten die ASDs. Onderzoek in diermodellen heeft aangetoond dat C difficile sporen omzetten in vegetatieve cellen binnen 1 uur na inname. Het is aannemelijk dat deze transformatie in de maag kan plaatsvinden als de pH hoger is of in het geval van tragere maagdoorgangstijden.
verschillende studies hebben een verband gevonden tussen het gebruik van PPI of H2A en CDI. Een recente retrospectieve cohortstudie toonde aan dat recidiverende CDI vaker voorkwam bij patiënten blootgesteld aan PPI ‘ s dan bij niet-blootgestelde patiënten (25,2% vs.18,5%) en dat PPI-gebruik tijdens CDI-behandeling geassocieerd was met een 42% verhoogd risico op recidief.12 blootgestelde patiënten ouder dan 80 jaar hadden het hoogste risico.Uit een recente analyse van gegevens van patiëntenontladingen uit een tertiair Medisch Centrum over een periode van 5 jaar bleek dat het risico op nosocomiale CDI positief gecorreleerd was met het niveau van zuursuppressie en het hoogst was bij patiënten die meer dan eenmaal per dag PPI-therapie kregen, wat wijst op een dosis-respons effect op het risico op nosocomiale CDI.13
pneumonie: Hoewel de resultaten van onderzoeken inconsistent zijn geweest, hebben verschillende studies een verband gevonden tussen het gebruik van ASDs en een verhoogd risico op luchtweginfecties en CAP. Een recente systematische beoordeling en meta-analyse suggereerde dat het gebruik van PPI ‘ s en H2As geassocieerd is met een groter risico op zowel CAP als HAP, waarbij een schatting wordt gemaakt van het optreden van één geval van pneumonie voor elke 200 met ASDs behandelde patiënten.Gezien het feit dat 40% tot 70% van de patiënten ASDs ontvangt, kan de omvang van de morbiditeit en mortaliteit van HAP volledig worden ingeschat. De grootste toename in het risico op pneumonie geassocieerd met PPI ‘ s werd waargenomen in de eerste week van gebruik.20
net als bij enterische infecties wordt aangenomen dat ASDs het risico op pneumonie verhoogt door remming van de secretie van maagzuur, waardoor bacteriële overgroei en kolonisatie mogelijk is. Bacteriën kunnen dan worden getransloceerd naar de longen door aspiratie.Bij mechanisch geventileerde patiënten kan orofaryngeale kolonisatie met gramnegatieve organismen leiden tot maagkolonisatie.19 Een andere theorie is dat waterstofkalium adenosine trifosfatase niet alleen aanwezig is in de pariëtale cellen van de maag, maar ook in de luchtwegen.Remming van dit enzym door een PPI kan bacteriegroei in de luchtwegen stimuleren, waardoor het risico op longontsteking toeneemt.Tot slot, in vitro studies hebben aangetoond dat ASDs de functie van neutrofielen en de activiteit van natural killer cellen kan aantasten.20
patiënten ouder dan 65 jaar hebben een verhoogd risico op pneumonie als gevolg van ASDs. Niet alleen zijn oudere patiënten over het algemeen hypochlorisch vanwege het verouderingsproces, maar het gebruik van PPI of H2A is gebruikelijk in deze groep; tot 5% neemt deze medicijnen regelmatig, en een hoog percentage gehospitaliseerde oudere patiënten krijgt SUP.21 bovendien, vereisen vele PPI ‘ s en H2As geen voorschrift, resulterend in verhoogd en unmonitored gebruik, vaak voor lange periodes zonder medisch toezicht.21
andere risico ‘ s: naast CDI zijn andere enterische infecties—met name door Salmonella en Campylobactersoorten—in verband gebracht met ASDs. Zowel Campylobacter als Salmonella zijn zuurgevoelige microben. Parasitaire infecties zijn verbonden met zure onderdrukking ook, vooral giardiasis en strongyloidiasis.Zoals eerder vermeld, maagzuur is belangrijk bij het doden van ingenomen organismen, maar een verhoogde maag pH kan andere negatieve effecten op GI gastheer afweer, zoals vertraagde maaglediging, verhoogde bacteriële translocatie, verminderde maag-slijm viscositeit, en veranderingen in de normale microbiële flora.
geneesmiddelinteracties zijn een andere bron van zorg bij de zuursuppressie. Geneesmiddelen met pH-afhankelijke absorptie (bijv. digoxine, nifedipine, indinavir, midazolam, didanosine, alendronaat, methadon, aspirine) kunnen zowel door PPI ‘ s als door H2As worden beïnvloed, wat resulteert in een verhoogde absorptiesnelheid.9,24 ook hebben verschillende geneesmiddelen de absorptiepercentages verlaagd (d.w.z. ketoconazol, cefpodoxime, dipyridamol, atazanavir, itraconazol).Er zijn veel CYP450-gerelateerde interacties tussen PPI ‘ s en andere geneesmiddelen. De mogelijke interactie tussen PPI ‘ s en clopidogrel heeft de aandacht getrokken vanwege mogelijke ernstige bijwerkingen. In een veiligheidsalarm van de FDA in November 2009 werd aanbevolen het gebruik van omeprazol of esomeprazol met clopidogrel te vermijden, waarbij werd gewaarschuwd dat de CYP-gemedieerde interactie de werkzaamheid van clopidogrel zou kunnen verminderen.22 vanwege onvoldoende gegevens heeft de FDA geen specifieke aanbevelingen gedaan met betrekking tot andere PPI ‘ s.
er zijn verscheidene gevallen gemeld van patiënten met hypomagnesiëmie en daaropvolgende hypokaliëmie en hypocalciëmie die levensbedreigende symptomen vertoonden die ziekenhuisopname vereisten. De meeste van deze gevallen werden geassocieerd met langdurig gebruik van PPI. Het mechanisme van deze bijwerking is onbekend. Bij patiënten met PPI-geïnduceerde hypomagnesiëmie heeft zich geen duidelijke magnesiummalabsorptie of renale magnesiumafvoer voorgedaan.Hoewel hypomagnesiëmie zeldzaam is, omdat het zo levensbedreigend is, worden zorgverleners aangemoedigd om zorgvuldig te letten op onverklaarbare hypomagnesiëmie, hypokaliëmie of hypocalciëmie bij PPI-gebruikers.
het gebruik van PPI ‘ s gedurende 12 maanden of langer is in verband gebracht met vitamine B12-deficiëntie, met name bij oudere patiënten.9 maagzuur en pepsine maken de afgifte van ingenomen vitamine B12 uit zijn eiwitgebonden toestand mogelijk; daarom kan vermindering van maagzuur leiden tot malabsorptie en vitamine B12-deficiëntie.De studieresultaten waren inconsistent en er zijn grotere studies nodig om het verband tussen PPI-gebruik en vitamine B12-malabsorptie en daaropvolgende deficiëntie vast te stellen. Slechte absorptie van ijzer in de voeding is ook gekoppeld aan PPI-therapie, maar de huidige gegevens zijn zwak. Maagzuur vergemakkelijkt de absorptie van nonheme ijzer door ijzer te verminderen tot de meer oplosbare ferro vorm, en verbetert ook ijzer-zout dissociatie van ingenomen voedsel.Er bestaan verschillende casusrapporten, maar er zijn op dit gebied geen prospectieve studies uitgevoerd.
langdurig gebruik van PPI is in verband gebracht met een verhoogde incidentie van fracturen. Mogelijke mechanismen omvatten verminderde absorptie van calcium in een meer alkalische maagomgeving en verminderde botremodellering als gevolg van verminderde osteoclastactiviteit, wat leidt tot geremd microfractuurherstel.22 Nogmaals, studies zijn inconsistent, maar bestaand bewijs was genoeg om de FDA te vragen om de PPI-etikettering in Mei 2010 te herzien om nieuwe veiligheidsinformatie over het mogelijke verhoogde risico van breuken van de heup, pols en wervelkolom op te nemen.Het risico op fracturen kan klinisch significant zijn bij patiënten met osteoporose of andere risicofactoren voor fracturen, zoals het gebruik van steroïden. Artsen worden aangemoedigd om de risico ‘ s en voordelen van PPI-gebruik bij kwetsbare patiënten af te wegen. Als calciumsupplementen aan PPI-gebruikers worden voorgeschreven, zouden zij in een oplosbare vorm, zoals citraat, eerder dan carbonaat moeten zijn.22
geschikt gebruik
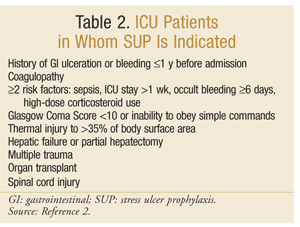
de American Society of Health-System Pharmacists heeft een van de meest uitgebreide op bewijsmateriaal gebaseerde richtlijnen voor SUP ontwikkeld. De huidige therapeutische richtlijnen werden gepubliceerd in 1999, met een update aan de gang bij dit schrijven.SUP wordt niet aanbevolen voor niet-ICU patiënten; profylaxe wordt alleen aanbevolen voor IC patiënten die mechanische beademing nodig hebben gedurende meer dan 48 uur, een voorgeschiedenis hebben van maag-darmzweren of bloedingen binnen 1 jaar voor opname, of die coagulopathie hebben. Profylaxe wordt ook aanbevolen voor patiënten op de intensive care met ten minste twee van de volgende risicofactoren: sepsis, een verblijf op de intensive care langer dan 1 week, occulte bloedingen van 6 dagen of langer en het gebruik van hoge doses corticosteroïden (Hydrocortison >250 mg/dag of equivalent). Daarnaast wordt SUP aanbevolen voor speciale ICU-populaties, zoals patiënten met een Glasgow Coma Score <10 (of onvermogen om eenvoudige opdrachten te gehoorzamen), thermisch letsel tot >35% van het lichaamsoppervlak, leverfalen of gedeeltelijke hepatectomie, meervoudig trauma, transplantaties of ruggenmergletsel.2 de aanbevelingen zijn samengevat in Tabel 2.
conclusie: rol van apotheker
inspanningen van artsen om het gebruik van ASD ‘ s bij niet-IC-patiënten te beteugelen, kunnen significante morbiditeit van patiënten voorkomen en zowel de ziekenhuiskosten als de kosten voor het algemene gezondheidszorgsysteem verlagen. Het is belangrijk om de risico ‘ s en voordelen van ASDs zorgvuldig af te wegen alvorens deze medicijnen in de intramurale setting te gebruiken. Speciale aandacht dient te worden besteed aan patiënten die al een risico lopen op longontsteking, zoals ouderen, patiënten met chronische longziekte en patiënten die immunosuppressiva gebruiken. Alles moet in het werk worden gesteld om de zuuronderdrukkende therapie bij patiënten kritisch te beoordelen en om de therapie waar mogelijk te staken. Wanneer SUP geïndiceerd is, dient de patiënt de laagst mogelijke dosis te krijgen.
apothekers kunnen het gebruik van ASDs helpen tegengaan door patiënten te identificeren aan wie deze geneesmiddelen onjuist zijn voorgeschreven, en zij kunnen een belangrijke rol spelen bij het opleiden van artsen over welke patiënten SUP moeten krijgen. Apothekers die betrokken zijn bij de verwerking van ontslagmedicijnen kunnen helpen ervoor te zorgen dat patiënten niet naar huis worden gestuurd op zuur-onderdrukkende therapie zonder een geschikte indicatie. Helaas hebben de maatregelen die zijn genomen om stresszweren bij gehospitaliseerde patiënten te voorkomen een nieuw probleem gecreëerd, en door samen te werken kan het gezondheidszorgteam verdere onnodige morbiditeit helpen voorkomen door richtlijnaanbevelingen in hun instelling af te dwingen.
1. Spirt MJ. Stress-gerelateerde mucosale ziekte: risicofactoren en profylactische therapie. Clin Ther. 2004;26:197-213.
2. ASHP therapeutische richtlijnen voor stress ulcus profylaxe. ASHP Commissie voor therapeutica en goedgekeurd door de ASHP Raad van bestuur op 14 November 1998. Am J Health Syst Pharm. 1999;56:347-379.
3. Cook DJ, Griffith LE, Walter SD, et al. De toe te schrijven mortaliteit en duur van de intensive care unit verblijf van klinisch belangrijke gastro-intestinale bloedingen bij ernstig zieke patiënten. Crit Zorg. 2001;5:368-375.
4. Cook DJ, Fuller HD, Guyatt GH, et al. Risicofactoren voor gastro-intestinale bloedingen bij ernstig zieke patiënten. Canadian Critical Care Trials Group. N Engl J Med. 1994;330:377-381.
5. Zuckerman GR, Shuman R. therapeutische doelen en behandelingsopties voor preventie van stress ulcus syndroom. Am J Med. 1987;83:29-35.
6. Harris SK, Bone RC, Ruth WE. Gastro-intestinale bloeding bij patiënten in een respiratoire intensive care unit. Borst. 1977;72:301-304.
7. Sesler JM. Stress-gerelateerde mucosale ziekte in de intensive care unit: een update over profylaxe. AACN Adv Crit zorg. 2007;18:119-128.
8. Grube RR, May DB. Stress ulcus profylaxe bij gehospitaliseerde patiënten niet in intensive care eenheden. Am J Health Syst Pharm. 2007;64:1396-1400.
9. Heidelbaugh JJ, Goldberg KL, INADOMI JM. Overgebruik van protonpompremmers: een overzicht van kosteneffectiviteit en risico bij PPI. Am J Gastro-Enterol. 2009; 104 (suppl 2): S27-S32.
10. Heidelbaugh JJ, Inadomi JM. Omvang en economische impact van ongepast gebruik van stress ulcer profylaxe bij niet-ICU gehospitaliseerde patiënten. Am J Gastro-Enterol. 2006;101:2200-2205.
11. Hussain S, Stefan M, Visintainer P, Rothberg M. Why do physicians prescribe stress ulcer profylaxe to general medicine patients? South Med J. 2010; 103: 1103-1110.
12. Linsky A, Gupta K, Lawler EV, et al. Protonpompremmers en risico op recidiverende Clostridium difficile-infectie. Arch Stagiair Med. 2010;170:772-778.
13. Howell MD, Novack V, Grgurich P, et al. Iatrogene maagzuur onderdrukking en het risico van nosocomiale Clostridium difficile infectie. Arch Stagiair Med. 2010;170:784-790.
14. Kyne L, Hamel MB, Polavaram R, Kelly CP. Gezondheidszorg kosten en mortaliteit geassocieerd met nosocomiale diarree als gevolg van clostridum difficile. Clin Infecteert Dis. 2002;34:346-353.
15. Schroeder MS Clostridium difficile-geassocieerde diarree. Am Fam Arts. 2005;71:921-928.
16. McMaster-Baxter NL, Musher DM. Clostridium difficile: recente epidemiologische Bevindingen en vorderingen in therapie. Farmacotherapie. 2007;27:1029-1039.
17. Kelly CP, Pothoulakis C, LaMont JT. Clostridium difficile colitis. N Engl J Med. 1994;330:257-262.
18. Cunningham R, Dial S. voedt overmatig gebruik van protonpompremmers de huidige epidemie van Clostridium difficile-geassocieerde diarree? J Hosp Infecteert. 2008;70:1-6.
19. Vakil N. zuurremming en infecties buiten het maagdarmkanaal. Am J Gastro-Enterol. 2009; 104:S17-S20.
20. Eom CS, Jeon CY, Lim JW, et al. Gebruik van zuur-onderdrukkende geneesmiddelen en risico op longontsteking: een systematische herziening en meta-analyse. CMAJ. 2011;183:310-319.
21. Eurich DT, Sadowski CA, Simpson SH, et al. Recidiverende, door de gemeenschap verworven pneumonie bij patiënten die zuuronderdrukkende geneesmiddelen starten. Am J Med. 2010;123:47-53.
22. Sheen E, Triadafilopoulos G. nadelige effecten op lange termijn protonpomp inhibitor therapie. Dig Dit Sci. 2011;56:931-950.
23. Bel MS. protonpompremmer gebruik en enterische infecties. Am J Gastro-Enterol. 2009; 104 (suppl 2): S10-S16.
24. Lahner E, Annibale B, Della Fave G. Systematic review: impaired drug absorption related to the co-administration of antisecretory therapy. Geneesmiddelen Voor Diergeneeskundig Gebruik 2009;29:1219-1229.
25. American Society of Health-System Pharmacists. Therapeutisch guidelines.www.ashp.org/Import/practiceandpolicy/PolicyPositionsGuidelinesBestPractices/BrowsebyDocumentType/TherapeuticGuidelines.aspx. Geraadpleegd op 19 September 2011.